
【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。
【答案】随反应物浓度降低,反应速率减慢 ![]() 500mL容量瓶 AD 25mL 2
500mL容量瓶 AD 25mL 2 ![]()
![]()
【解析】
随着反应的进行,反应物的浓度逐渐降低,故浓度对反应速率的影响是会导致反应速率减慢,而根据题意可知,反应速率是先慢后快,故不可能是浓度导致的反应速率的变化,故答案为:随反应物浓度降低,反应速率减慢;
【设计完成实验】(1)配制500mL![]()
![]() 溶液,所需的草酸的物质的量
溶液,所需的草酸的物质的量![]() ,即需要的草酸晶体
,即需要的草酸晶体![]() 的物质的量为
的物质的量为![]() ,质量
,质量![]() ,故答案为:
,故答案为:![]() ;
;
①配制过程中用到的仪器是:托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,其中用到的2种定量仪器是托盘天平和500mL容量瓶,故答案为:500mL容量瓶;
②A、称取草酸晶体时,将草酸晶体放在托盘天平右盘此时![]() ,会导致所称量的药品的质量偏小,则浓度偏低,故A选;
,会导致所称量的药品的质量偏小,则浓度偏低,故A选;
B、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故B不选;
C、只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故C不选;
D、摇匀后,发现溶液液面低于刻度线是正常的,立即用胶头滴管加水,会导致溶液的浓度偏低,故D选;
AD正确,故答案为:AD;
(2)若要探究![]() 对该反应有无催化作用,必须保持其他的影响因素如
对该反应有无催化作用,必须保持其他的影响因素如![]() 的浓度、
的浓度、![]() 的浓度以及稀硫酸的浓度与实验1是相同的,而
的浓度以及稀硫酸的浓度与实验1是相同的,而![]() 、
、![]() 以及稀硫酸的加入的物质的量相同,故若使浓度相同,则必须使溶液体积与实验1相同,故加入的水的体积
以及稀硫酸的加入的物质的量相同,故若使浓度相同,则必须使溶液体积与实验1相同,故加入的水的体积![]() ,根据溶液褪色的时间可以看出,
,根据溶液褪色的时间可以看出,![]() 对该反应有催化作用,导致反应速率加快,溶液褪色的时间缩短,故假设2是成立的,故答案为:25mL;2;
对该反应有催化作用,导致反应速率加快,溶液褪色的时间缩短,故假设2是成立的,故答案为:25mL;2;
(3)根据题干信息可知:![]() 溶液与
溶液与![]() 发生氧化还原反应,
发生氧化还原反应,![]() 被还原为
被还原为![]() ,
,![]() 被氧化为
被氧化为![]() ,故离子方程式为:
,故离子方程式为:![]() ;设
;设![]() 溶液的物质的量浓度为
溶液的物质的量浓度为![]() ,根据反应:
,根据反应:
可得:![]() 解得
解得![]() ,故答案为:
,故答案为:![]() 。
。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的![]() -硫,后来证明含有S6分子。下列说法正确的是
-硫,后来证明含有S6分子。下列说法正确的是
A.S6和S8分子都是由S原子组成,所以它们是一种物质
B.S6和S8分子分别与铁粉反应,所得产物不同
C.S6和S8分子分别与过量的氧气反应可以得到SO3
D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象能得出相应结论的是![]()
选项 | 操作 | 现象 | 结论 |
A | 将KI和 | 下层溶液显紫红色 | 氧化性:
|
B | 向盛有 | 2min后,试管里出现凝胶 | 非金属性:
|
C |
| 先出现白色沉淀后又有红褐色沉淀产生 | 溶解度:
|
D | 向 | 有黑色沉淀 | 酸性:
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下水的离子积常数为Kw,下列溶液一定呈中性的是( )
A.pH=7的溶液B.c(H+)=![]() mol·L-1的溶液
mol·L-1的溶液
C.由强酸、强碱等物质的量反应得到的溶液D.非电解质溶于水得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)生活中明矾常作净水剂,其净水的原理是___(用离子方程式表示)。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后(忽略溶液体积的变化),溶液中的氢离子浓度为___。
(3)现将0.2mol·L-1的NH3·H2O溶液与0.1mol·L-1的HCl溶液等体积混合,写出该混合溶液质子守恒式:___。
(4)FeCl2溶液蒸干并灼烧得到的物质是___(填化学式)。
(5)浓度均为0.1molL﹣1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是___。(用序号表示)
(6)在常温下,现有下列四种溶液:①0.1mol·L-1 CH3COONH4溶液,②0.1mol·L-1NH4HSO4溶液,③0.1mol·L-1 NH3·H2O和0.1mol·L-1 NH4Cl混合溶液,④0.1mol·L-1 NH3·H2O溶液。比较①、②、③、④溶液中c(NH4+)由小到大的顺序为___(用序号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体![]() 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有![]() ,产生的气体中含有CO、
,产生的气体中含有CO、![]() 。
。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:①蒸馏水②![]() 溶液③氧化铜④
溶液③氧化铜④![]()
![]() 盐酸⑤浓硫酸⑥
盐酸⑤浓硫酸⑥![]()
![]() 溶液⑦澄清石灰水⑧
溶液⑦澄清石灰水⑧![]()
![]()
![]() 溶液 ⑨
溶液 ⑨![]() 溶液⑩苯酚溶液
溶液⑩苯酚溶液
(1)若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有![]() 生成,应选用的试剂为
生成,应选用的试剂为![]() 按先后顺序把所选试剂的标号填入空格内
按先后顺序把所选试剂的标号填入空格内![]() ______。
______。
(2)提出合理假设
假设1:只有Fe;假设2:只有FeO;假设3: ______ 。
(3)设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放入试管中,加入足量 ______ 溶液,充分振荡。若固体无明显变化,则假设 ______ 成立;若有暗红色固体生成,则反应的离子方程式为 ______ 。
步骤3:取步骤2所得暗红色固体于试管中,滴加过量 ______ ,振荡后静置。若溶液基本无色,则假设 ______ 成立;若溶液呈 ______ ,则假设3成立。
(4)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定。请你设计实验方案证明假设3成立![]() 写出实验的操作步骤、现象与结论
写出实验的操作步骤、现象与结论![]() : ______。
: ______。
(5)拓展与延伸
有资料介绍“在含![]() 的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的
的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的![]() 价铁还能被氯水氧化为更高价的
价铁还能被氯水氧化为更高价的![]() ,试写出该反应的离子方程式 ______。
,试写出该反应的离子方程式 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的 HCN 气体,同时 HCN 又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
下列选项错误的是( )
A.向NaCN溶液中通入少量CO2发生的离子反应为2CN-+H2O+CO2=2HCN+![]()
B.相同浓度的 HCOOH和NaCN 的溶液中,水的电离程度前者小
C.中和等体积、等pH 的 HCOOH 溶液和 HCN 溶液消耗 NaOH 的物质的量前者小于后者
D.等体积、等物质的量浓度的 HCOONa 和 NaCN 溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定分析是一种常用的定量分析法。请回答下列问题:
Ⅰ.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_________________________,直到因加入一滴盐酸后,溶液由黄色突变为橙色,并半分钟内不恢复为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_________(填字母序号)。
a.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
b.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
c.酸式滴定管在滴定前有气泡,滴定后气泡消失
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
Ⅱ.25℃时,向20mL 0.1 mol·L-1的HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示。

(3)①滴加NaOH溶液至恰好反应的过程中,水的电离程度_____________(填写“逐渐增大”、“不变”或“逐渐减小”);
②若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HA溶液的浓度,推测最好使用的指示剂为___________________________(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10)。
③b点时,共滴入0.1 mol·L-1NaOH溶液体积为V mL,用含V的代数式表示HA的电离平衡常数Ka=__;
Ⅲ.KMnO4溶液常用作氧化还原反应滴定的标准液,四氯化硅粗产品经精馏后,得到的残留物中常含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
(4)①滴定前是否要滴加指示剂?_____________ (填“是”或“否”),请说明理由:_____________________________________________;
②某同学称取10.000 g 残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用 1.000×10-2 mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水电离平衡如图所示,且pOH=-lg c(OH-)。下列说法错误的是
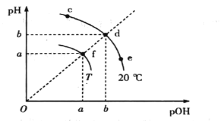
A.各点对应的水的离子积:Kw(f)>Kw(e)=Kw(d)
B.加热f点纯水,其组成由f点沿fd直线向d方向迁移
C.向c点溶液中通入少量HCl,其组成由c点沿cde曲线向e点移动
D.df直线上各点对应的水溶液(或纯水)一定显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com