
���� ��1����������һ�����ʵ���Ũ����Һһ�㲽����
��2������һ�����ʵ���Ũ����Һһ�㲽�裬ȷ��ʹ�õ�����������������Һ���ѡ����ʵ�����ƿ��
��3���������������ʵ����ʵ�������Һ�����Ӱ�죬����C=$\frac{n}{V}$������������
��� �⣺��1������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ�
�ʴ�Ϊ���ܽ⣻��Һ��ϴ�ӣ�
��2������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȣ��õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ�����1.00mol/L���Ȼ�����Һ0.5L��Ӧѡ��500mL����ƿ�����Ի���Ҫ��������ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ�
�ʴ�Ϊ��500mL��ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ�
��3����Ϊ���ٹ����ܽ����Ϊ���Ȳ����Ͻ��裮��δ��������ʱ����������Һת�Ƶ�����ƿ���ݣ���ȴ����Ϊ��������Ե�ʣ�Һ���½�����Һ���С��500mL�����Ե�����ҺŨ��ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ���������Ե�ʣ�Һ���½�����Һ���С��500mL��
�ڶ��ݺӸǵ�תҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ���̶��ߣ�������Һ���ƫ����ҺŨ��ƫ�ͣ�
�ʴ�Ϊ��ƫ�ͣ�ҡ�Ⱥ��ټ�����ˮ������Һ���ƫ��
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƣ���ȷ����ԭ�������� �����ǽ���ؼ���ע���������ķ����ͼ��ɣ�


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
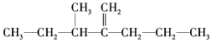 ��ϵͳ����Ϊ��3-��-2-����-1-��ϩ
��ϵͳ����Ϊ��3-��-2-����-1-��ϩ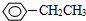 ��?H COOH����CH3COOC2H5��
��?H COOH����CH3COOC2H5��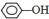 ����CH2=CH2����CH��CH����
����CH2=CH2����CH��CH����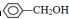 ����
����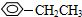 ��
��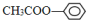 ����CH3CH2CH2CH2Br������NaOH��Һ��Ӧ����������Na2CO3��Һ��Ӧ���Ǣޢߣ� ����д�������ʵ���ţ�
����CH3CH2CH2CH2Br������NaOH��Һ��Ӧ����������Na2CO3��Һ��Ӧ���Ǣޢߣ� ����д�������ʵ���ţ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
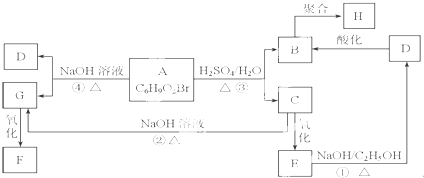
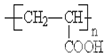 ��
��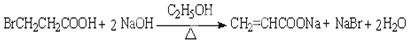
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
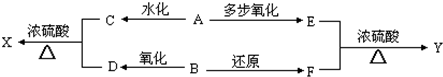
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-542.7kJ/mol | |
| B�� | 2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1059.3kJ/mol | |
| C�� | 2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1076.7kJ/mol | |
| D�� | N2H4��g��+$\frac{1}{2}$N2O4��g��=$\frac{3}{2}$N2��g��+2H2O��g����H=-1076.7kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�2.24L H2O���еķ�����Ϊ0.1NA | |
| B�� | ��״���£�2.24L H2 ���еķ�����Ϊ0.1mol | |
| C�� | ������ΪNA ��CO��N2�����������ԼΪ22.4L������Ϊ28g | |
| D�� | 1mol CH4�����������ĵ�������Ϊ10 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú�ĸ��� | B�� | ʯ�͵ķ��� | C�� | ��ˮ������ | D�� | ��ȡ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬʱ���� | B�� | ͬʱ���� | C�� | V1����V2��С | D�� | V1��С��V2���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com