
| A. | 所有的化学反应 | B. | 可逆反应 | ||
| C. | 氧化还原反应 | D. | 气体物质之间的反应 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
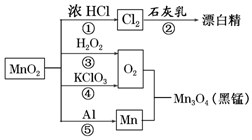
| A. | 只有反应①②④属于氧化还原反应 | |
| B. | 反应⑤说明该条件下铝可用于制熔点较高的金属 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 | |
| B. | 下雪后,常用播撒NaCl颗粒方法来防止道路结冰 | |
| C. | 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同 | |
| D. | 在医学上用BaSO4做钡餐,是因为Ba2+对人体无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
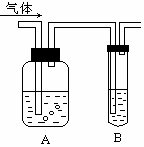 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
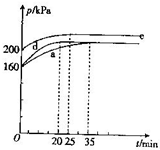 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/ | 容器体积/L | ClO2(g)的平衡转化率 |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
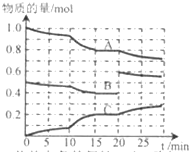 在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com