
����Ŀ�����з�ӦmA��g��+nB��g��pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʼ�С������Сѹǿʱ�������ϵ��A����������������
��1���÷�Ӧ������Ӧ���ȷ�Ӧ����m+np �����������������=������
��2������ѹǿʱ��B��ת���������������С�����䡱����ͬ�����淴Ӧ���� ��
��3��������C��������䣩����A��������� ��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ![]() ��ֵ�� ��
��ֵ�� ��
��5��������������÷�Ӧ�ķ�Ӧ�� ��
��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ�ά������������䣬��������ʱ������������ɫ�����dz������������䡱����
���𰸡�
��1���ţ���
��2����������
��3����С
��4������
��5������
��6������
���������⣺��1���ﵽƽ��������¶�ʱ��B��ת���ʼ�С��˵���¶�����ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ�����Сѹǿʱ�������ϵ��A��������������˵��ѹǿ��Сƽ�����淴Ӧ�����ƶ�����ʽ�з�Ӧ�������ļ�����֮�ʹ�������������Ļ�ѧ������֮�ͣ����Դ��ǣ��ţ�������2������ѹǿʱ��ƽ�����ŷ���ʽ������ļ�����֮������ķ�Ӧ�����ƶ�������������Ӧ�����ƶ�����B������������С������ѹǿ���淴Ӧ���ʶ��ӿ죬���Դ��ǣ���С������3��������C��������䣩���൱������ѹǿ����ƽ����������Ӧ�����ƶ�����A�����������С�����Դ��ǣ���С����4������Ӧ���ȣ��������¶ȣ�ƽ�������ƶ���C�����ʵ������࣬B�����ʵ�����С�����Զ��ߵ�Ũ�ȱ�ֵ���������Դ��ǣ�����5�������Ի�ѧƽ���ƶ�û��Ӱ�죬����������������÷�Ӧ�ķ�Ӧ�Ȳ��䣬���Դ��ǣ����䣻��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ���������ʱ��ƽ�ⲻ�ƶ�������ֵ����ʵ������䣬ά������������䣬���Ը���ֵ�Ũ�Ȳ��䣬����������ɫ���䣬 ���Դ��ǣ����䣮
�����㾫����������Ĺؼ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����֪ʶ�����ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ���Լ��Ի�ѧƽ��״̬���ʼ����������⣬�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(��)��3H2(��)![]() 2NH3(��)����H<0������˵����ȷ����(����)
2NH3(��)����H<0������˵����ȷ����(����)
A.�ﵽƽ��ʱ��Ӧ���������Ũ��һ�����
B.�ﵽƽ�����백�������´ﵽƽ��ʱ��������Ũ�ȱ�ԭƽ��ʱ��
C.�ﵽƽ��ʱ�������¶ȼӿ������ȷ�Ӧ�����ʣ������˷��ȷ�Ӧ�����ʣ�����ƽ�����淴Ӧ�ķ����ƶ�
D.��������������̵���ƽ���ʱ�䣬������Ϊ�ӿ�������Ӧ�����ʣ����������淴Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ���Ƿ��չ�ҵ�Ʊ�����Ĺ���������Ƴ����ģ�����̽����ҵ��Ϊ�β���98.3%��Ũ����������������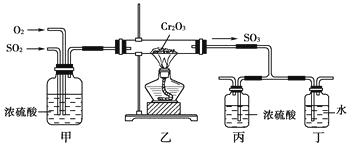
����д���пհף�
��1��д����ҵ����FeS2��ȡSO2�Ļ�ѧ����ʽ����
��2��д����ͼ�в���װ�õ����ã��ټ���
�ڱ��Ͷ�����
��3������װ���ڷ�Ӧ�����г������ݣ����þͳ����˰���������װ��һֱû�����Ա仯��������������Ŀ���ԭ���ǣ��ٱ��в���Ũ�����еĵ��ܲ���̫�ʹ��������ƿ�ڵ�ѹǿ��ϴ���SO3�Ӷ���ˮ��ð�˳�������ˮ�γ�����������
��4����ͼװ���еļ��Ҳ��֡����Ͷ����ֱַ��빤ҵ��ȡ�����װ�����Ӧ�������൱�������Ͷ��൱����
��5�������Ṥҵ�Ʒ��У����ж�����������˵��������������Ҫԭ�����������ȷ����________(������ѡ������)��
A.������ȼ��ǰ��Ҫ���飬��Ϊ�������������ڿ�����ȼ��
B.�ӷ���¯������¯���辻������Ϊ¯���ж�����̼�������ʷ�Ӧ
C.������������Ϊ��������ʱ��ʹ�ô���������������߶��������ת����
D.����������98.3%��Ũ������Һ���գ�Ŀ���Ƿ�ֹ�γ�������������������������Ч��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��÷���ʯ[Ca5(PO4)3F]Ϊԭ�ϣ�������ͼ��ʾ������ȡ���ᡢ�ع������[Ca(H2PO4)2]������ᡣͼ�з�Ӧ(��)Ϊ����ʯ����һ��ԭ�Ϸ�Ӧ������A��B��C�������ʣ����еIJ���C�ָ�����ʯ������Ӧ(��)������B���ع�����ơ�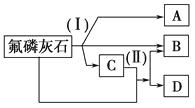
��д��������Ӧ�Ļ�ѧ����ʽ����Ӧ(��)����Ӧ(��)��
��������Ҫ�ر�ע��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С��̽����������Ի�ѧ��ӦmA��g��+nB��g��pC��g�������ʺ�ƽ���Ӱ��ͼ�����£������ж���ȷ���ǣ� �� 
A.��ͼ1��֪��T1��T2 �� �÷�Ӧ����ӦΪ���ȷ�Ӧ
B.��ͼ2��֪���÷�Ӧm+n��p
C.ͼ3�У���ʾ��Ӧ����v����v�����ǵ�3
D.ͼ4�У���m+n=p����a����һ��ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ������ǰ��ֶ�����Ԫ�ص������Ϣ����֪���ԭ�Ӱ뾶Ϊ0.089nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
Fԭ���������ӣ�G����������븺������ȣ��������������Ǵ����Ķ�����HԪ�ص�����ɫ��Ӧ�ʻ�ɫ��
��1��CԪ����Ԫ�����ڱ��е�λ�� �� B�γɵļ����ӵĽṹʾ��ͼ ��
��2����������Ԫ�ص�����������Ӧ��ˮ������������ǿ�������ѧʽ����
��3���õ���ʽ��ʾA��D�γɻ�����Ĺ��̣� ��
��4��H��E�γ�ԭ�Ӹ�����Ϊ1��1�Ļ�������������ѧ������Ϊ ��
��5��GE2�ĵ���ʽΪ �� F��G�γɵ���Ļ�����ĽṹʽΪ ��
��6��E���⻯���C���⻯����۷е�ߵ�ԭ���� ��
��7��A��B��C��Eԭ�Ӱ뾶�ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ⷴӦ��һ����Ҫ�ķ�Ӧ���������ʲ���ˮ�����( )
A. ��֬ B. ���� C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ���������һ�������½������з�Ӧ��2SO2+O22SO3������ƽ��ʱͨ��18O2 �� �ٴ�ƽ��ʱ��18O�����ڣ� ��
A.SO2��O2
B.SO2��SO3
C.O2��SO3
D.SO2��O2��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ý����Ҫ�Ĵ�����CO��������ý���õ�����ʧȥ�����ԣ�Fe+5CO=Fe��CO��5����ȥCO�Ļ�ѧ��Ӧ����ʽΪ��
[Cu��NH3��2]OOCCH3+CO+NH3=[Cu��NH3��3��CO��]OOCCH3 ��
��ش��������⣺
��1��C��N��O�ĵ縺���ɴ�С��˳��Ϊ �� ��̬Feԭ�ӵļ۵����Ų�ͼΪ ��
��2��Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬��Fe��CO��5�ľ��������� �� ��CO��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ ��
��3�������[Cu��NH3��2]OOCCH3��̼ԭ�ӵ��ӻ������� �� �������ṩ�¶Ե��ӵ�ԭ���� ��
��4����[Cu��NH3��2]OOCCH3��ȥCO�ķ�Ӧ�У��϶����γɣ�
a�����Ӽ� b����λ�� c���Ǽ��Լ� d���ļ�
��5��NaAlH4����ľ�����ͼ��
��Na+�����ҵȾ��AlH4��������NaAlH4������ܶ�Ϊgcm��3���ú�a�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com