
【题目】甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙).丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24.下列判断正确的是( )
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
【答案】C
【解析】解:甲、乙、丙、丁为四种短周期元素,由甲与乙、丙、丁在周期表中的位置关系可知,甲位于第二周期,原子序数:乙>丙,且丁的原子序数与乙、丙原子序数之和相等,故甲与丁处于同主族,甲与乙、丙处于同一周期,乙在甲的右侧相邻、丙在甲的左侧相邻,令甲的原子序数为x,则乙为x+1、丙为x﹣1,丁为x+8,则x﹣1+x+1=x+8,解得x=8,故甲为O、乙为F、丙为N、丁为S,
A.同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的稳定性越强,F的非金属性大于O元素,所以乙的氢化物的稳定性大于甲,故A错误;
B.乙原子核外有2个电子层,最外层电子数是7,则乙在周期表中位于第二周期第VIIA族,故B错误;
C.丙为N元素,丁为S元素,硝酸和硫酸都是强酸,则元素丙和元素丁的最高价氧化物对应的水化物均为强酸,故C正确;
D.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以离子半径为S2﹣>N3﹣>O2﹣>F﹣ , 故D错误;
故选C.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】香豆素是用地广泛的香料,合成香豆素的路线如图(其他试剂、产物及反应条件均省略): 
(1)Ⅰ的分子式为;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为;
(2)反应②的反应类型是 , 反应④的反应类型是;
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为;
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能发生银镜反应,也可与碳酸氢钠溶液反应,Ⅴ的结构简式为(任写一种);
(5)一定条件下, ![]() 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宣传科学知识,介绍高新科技,推广高新技术,揭露伪科学,是科学工作者和当代中学生的义务。下列说法中不属于伪科学的是( )
A.没有水就没有生命
B.这种饮料中不含任何化学物质
C.这种口服液中含丰富的氮、磷、镁等微量元素
D.这种环保汽车不消耗任何能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10g铁粉置于40ml的HNO3溶液中,微热,反应随着HNO3浓度的降低生成气体的颜色由红棕色变为无色,充分反应后共收集标况下1792mlNO,NO2的混合气体,溶液中还残留了4.4g固体. 请回答下面问题,并写出计算过程.
(1)求该反应中被还原和未被还原的HNO3的物质的量之比
(2)求原HNO3溶液物质的量浓度
(3)求NO、NO2体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN﹣氧化的反应).
【相关资料】
①氰化物主要是以CN﹣和[Fe(CN)6]3﹣两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3﹣较CN﹣难被双氧水氧化,且pH越大,[Fe(CN)6]3﹣越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
实验 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | 7 | 60 | 10 |
(2)实验测得含氰废水中的总氰浓度(以CN﹣表示)随时间变化关系如图所示.
实验①中20~60min时间段反应速率:υ(CN﹣)= molL﹣1min﹣1 .
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是 (填一点即可).在偏碱性条件下,含氰废水中的CN﹣最终被双氧水氧化为HCO3﹣ , 同时放出NH3 , 试写出该反应的离子方程式: .
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN﹣浓度可用离子色谱仪测定)
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图1所示实验装置制备少许Mg3N2 , 并探究其性质(图中夹持、固定装置均略去,图中A部分为产生氨气的装置). 
已知:①在加热条件下氨气可还原氧化铜生成两种单质和一种化合物;②在空气中加热镁粉可以得到氧化镁和极易水解的Mg3N2 .
(1)如图中仪器B的名称是 , 装置E中试剂的作用是
(2)若该同学用熟石灰和氯化铵制氨气,则A部分的最佳装置(图2)是(填序号),其中反应的化学方程式为:
(3)装置D中U型管内液体和新制氯水相比较,溶液中的微粒(包括离子、分子)种数(选填“前者多”、“后者多”或“相等”).
(4)实验前F中加入ag镁粉,实验后测得F中固体bg,则装置C中被还原的氧化铜的物质的量至少为mol,则实验测得氮化镁中镁、氮的原子个数比为(用含a、b字母的代数式表示).
(5)上述实验中若去掉制备装置右端的G装置会导致测得氮化镁中镁、氮的原子个数比(选填“偏大”、“偏小”、或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )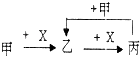
A.甲:Na,X:O2
B.甲:NaOH溶液,X:CO2溶液
C.甲:C,X:O2
D.甲:AlCl3溶液,X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油扭、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通人NH3和CO2 , 可以制得纳米级碳酸钙.某校学生实验小组设计下图所示装置制取该产品,D中装有稀硫酸的脱脂棉(图中夹持装置已略去).
I.可选用的药品有a.石灰石b.饱和氯化钙溶液c.6mol/L盐酸d.氯化铵固体e.氢氧化钙固体.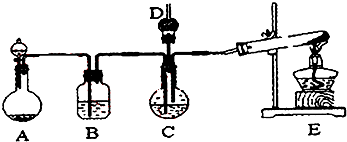
(1)A中制备气体时,所需药品是(选填字母序号);
(2)B中盛有溶液,其作用是;
(3)写出制取氨气的化学方程式;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体是(写化学式)
(5)检验D出口处是否有氨气逸出的方法是;
(6)写出制取纳米级碳酸钙的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A.反应①的平衡常数K1= ![]()
B.反应③的平衡常数K= ![]()
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应
D.对于反应③,恒温恒容下,增大压强,H2浓度一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com