C
分析:A、质量换算物质的量结合分子结构简式中子数;
B、质量换算物质的量.结合铜发生的氧化还原反应进行分析判断;
C、依据质量换算物质的量,结合氧元素守恒计算判断;
D、依据一氧化氮和氧气反应生成二氧化氮气体存在化学平衡分析判断;
解答:A、9g甲烷(
14CH
4)物质的量=
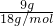
=0.5mol,含中子数=0.5×(14-6+0)×N
A=4N
A;故A错误;
B、64g的铜为1mol,可以生成二价铜失去2mol电子,也可以生成正一价铜失去1mol电子,故B错误;
C、48gO
2与O
3的混合气体中含氧原子物质的量=
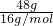
=3mol,48gO
2与O
3的混合物中氧原子个数为3N
A,故C正确;
D、标准状况时,11.2LNO和11.2LO
2物质的量分别为0.5mol,发生反应2NO+O
2=2NO
2;一氧化氮气体全部反应,生成0.5mol二氧化氮,剩余氧气0.25mol,但是二氧化氮气体和四氧化二氮形成化学平衡使分子数减少,所以11.2LNO和11.2LO
2混合后的气体中含有的分子总数小于0.75N
A,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常的应用,主要考查质量黄色物质的量计算微粒数,关键是一氧化氮和氧气常温下反应生成二氧化氮,二氧化氮和四氧化二氮存在化学平衡的理解.

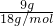 =0.5mol,含中子数=0.5×(14-6+0)×NA=4NA;故A错误;
=0.5mol,含中子数=0.5×(14-6+0)×NA=4NA;故A错误;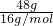 =3mol,48gO2与O3的混合物中氧原子个数为3NA,故C正确;
=3mol,48gO2与O3的混合物中氧原子个数为3NA,故C正确;

 名校通行证有效作业系列答案
名校通行证有效作业系列答案