
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
分析 根据N=nNA=$\frac{m}{M}$NA结合物质构成计算原子个数,据此解题.
解答 解:A.0.8molCO2含原子物质的量为0.8mol×3=2.4mol,故A错误;
B.22.4LO2的物质的量为1mol,含原子物质的量为1mol×2=2mol,故B错误;
C.3.6g水的物质的量为0.2mol,含原子物质的量为0.2mol×3=0.6mol,故C错误;
D.含NA个NH3分子的氨气的物质的量为1mol,含原子物质的量为1mol×4=4mol,故D正确.
故选D.
点评 本题考查物质的量有关计算,为高频考点,明确物质构成、物质的量公式中各个物理量关系即可解答,注意物质构成微粒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-OH | B. | CH3-CH2-CH2-OH | ||
| C. | HO-CH2-CH2-CH2-OH | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
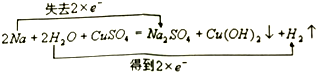 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2NO2+H2O═2HNO3+NO | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com