
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 常温常压下,8gO2和O3的混合气体含有4NA个电子
B. 1L0.1mol/L的FeCl3完全水解,形成0.1NA个Fe(OH)3胶体粒子
C. 标准状况下,22.4LCl2通入水中发生反应,转移的电子数为NA
D. 1molNa被完全氧化生成Na2O2,失去个2NA电子
【答案】A
【解析】
A、氧气和臭氧互为同素异形体,氧元素的质量分数都是100%,则混合气体中氧元素的质量分数都是100%,则混合气体中氧原子的质量为8g,由于n=![]() ,则氧原子的物质的量为0.5mol,氧原子的电子数等于质子数,1mol氧原子含有8mol电子,0.5mol氧原子含有4mol电子,选项A正确;
,则氧原子的物质的量为0.5mol,氧原子的电子数等于质子数,1mol氧原子含有8mol电子,0.5mol氧原子含有4mol电子,选项A正确;
B、水解是可逆的,而且胶体粒子是多个分子形成的聚合体,因此1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA,选项B错误;
C、标准状况下,22.4L Cl2的物质的量是1mol,通入水中生成次氯酸和盐酸,但该反应是可逆反应,因此反应过程中转移电子数小于NA,选项C错误;
D、1 mol钠反应失去1 mol电子,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中M为非金属元素![]() 下列说法正确的是
下列说法正确的是
![]()
A. M的最高价氧化物为一种酸酐
B. Z的离子半径是同周期各简单离子中最小的
C. X的气态氢化物的稳定性比Y的强
D. Z的氢化物酸性是同族中最强的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室利用铜与浓硫酸制取二氧化硫并探究它的性质,请回答下列问题:
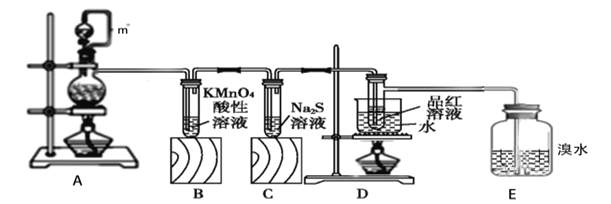
(1)装置A中m的作用___,装置A中有明显的一处错误___。
(2)装置A中发生的化学反应方程式___,该反应的氧化产物是__________。
(3)装置B中的现象________,证明SO2具有________。
(4)装置C中溶液在空气中不易保存,时间长了会出现浑浊,原因是_______。(用离子方程式表示)
(5)装置D的目的是探究SO2与品红作用的可逆性,写出实验操作及现象__。
(6)E中的现象是___,发生的化学反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X | Y | Z | |
原子半径/nm | 0.154 | 0.130 | 0.071 |
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:Z>X>Y
B. 三种元素可能为同周期元素
C. 原子序数:Y>X>Z
D. 离子半径:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
Ⅰ.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O![]() ,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
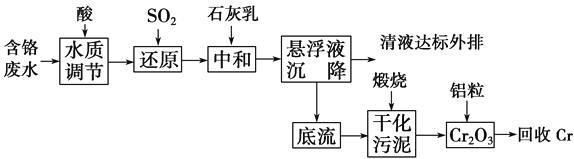
(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)写出加入铝粒时发生反应的化学方程式____________________________________。
Ⅱ.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(3)铬渣烧结炼铁法中煤粉的作用是____________。(写两点)
(4)请配平碱性溶液还原法中发生的离子反应:_______________
![]() Cr2O72-+
Cr2O72-+![]() S2-+
S2-+![]() H2O===
H2O===![]() Cr(OH)3↓+
Cr(OH)3↓+![]() S2O32-+
S2O32-+![]() OH-
OH-
(5)用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物可能是________(填序号);
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
在这些混合物中,各成分的物质的量之比是________。
Ⅲ.电解法处理
工业上处理含Cr2O72-离子的酸性废水,采用以下处理方法。①往工业废水中加入适量的食盐(1~2 g·L-1),搅拌均匀;②用Fe为电极进行电解;③鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准。其原理是:①将Cr2O![]() 离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
(6)加入食盐的目的是______________________________________________________;电解时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究溶液酸碱性对![]() 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL![]() 或10mL
或10mL![]() 溶液中。
溶液中。
I.![]() 溶液的配制
溶液的配制
将![]() 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
溶液编号 | 溶剂 | 溶液性状 | |
① | 蒸馏水 | 浅黄色澄清溶液: | 遇 |
② |
| 无色澄清溶液: | 遇 |
③ |
| 无色澄清溶液 | 遇 |
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II ![]() 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
溶液编号 | 溶液性状 | |
① | 橙色浑浊 | 用 |
② | 无色溶液 | 滴加5滴 |
③ | 无色溶液 | 滴加5滴 |
(分析讨论)①②说明酸性减弱时,![]() 溶液更易变质;②③说明……
溶液更易变质;②③说明……
(查阅资料)在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
(进行实验)用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通人氧气,待电流表示数稳定后:
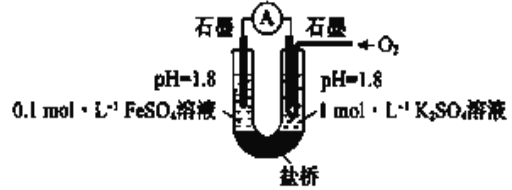
I 向左池滴加浓硫酸至![]() 接近
接近![]() ,电流没有明显变化
,电流没有明显变化
II 向右池滴加等量浓硫酸,电流明显增大。
(4)补全(分析讨论):②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中![]() 更易变质的原因是___________________
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中![]() 更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存![]() 溶液的最佳法是_________________。
溶液的最佳法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是___________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______,所得沉淀的最大质量是______g。
(4)若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?____(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = _____ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如下,下列说法正确的是
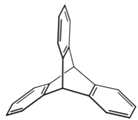
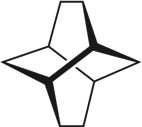
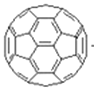
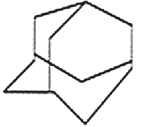
①(三碟烯) ②(扭曲烷) ③(富勒烯) ④(金刚烷)
A. ①③均能发生加成反应B. ①④互为同分异构体
C. 只有②③④属于烃D. ①②③④的一氯代物均只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在能源开发与利用中起着十分关键的作用。能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。甲烷、氢气是重要的能源。回答下列问题:
(1)关于甲烷、氢气的说法正确的是___
A.甲烷和氢气都是一级能源 B.甲烷是一级能源,氢气是二级能源
C.甲烷和氢气都是二级能源 D.甲烷是二级能源,氢气是一级能源
(2)![]() 经催化重整可以获得合成气:
经催化重整可以获得合成气:![]()
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H |
| H—H |
|
键能/ | 413 | 745 | 436 | 1075 |
则该反应的![]() _____
_____![]() 。
。
②已知:![]()
![]()
![]()
![]()
而C(s)的燃烧热![]()
该催化重整反应的![]() ___
___![]() (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(3)氢气是氯碱工业的副产品,产生氢气的电极反应式为___。
(4)利用氢气可以合成氨,将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() 写出
写出![]() 的电子式__。该反应的化学方程式为____。
的电子式__。该反应的化学方程式为____。
(5)CO也是一种重要燃料,利用其燃烧可以设计成新型燃料电池,该电池利用熔融的碳酸盐为电解质,该燃料电池负极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com