
下列有关化学反应速率的说法中,正确的是()
A. 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
考点: 化学反应速率的影响因素.
专题: 计算题.
分析: A.加入适量的氯化钠溶液,溶液体积增大,反应速率减小;
B.铁片和浓硫酸反应不生成氢气;
C.升高温度,反应速率增大;
D.减小压强,反应速率减小.
解答: 解:A.加入适量的氯化钠溶液,溶液体积增大,反应物浓度减小,则反应速率减小,故A错误;
B.铁片和浓硫酸在加热时生成二氧化硫,不加热发生钝化,反应不生成氢气,故B错误;
C.升高温度,活化分子百分数增大,反应速率增大,故C错误;
D.减小压强,活化分子浓度减小,反应速率减小,故D正确.
故选D.
点评: 本题综合考查化学反应速率的影响,为高频考点,侧重于学生的分析能力的考查,注意把握影响因素以及相关基础知识的学习,难度不大.


科目:高中化学 来源: 题型:
已知葡萄糖(C6H12O6)的燃烧热是2804kJ•mol﹣1,当它被氧化生成1mol水时放出的热量是()
A. 26.0kJ B. 5 1.9kJ C. 155.8kJ D. 467.3kJ
1.9kJ C. 155.8kJ D. 467.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
在微生物作用下,NH4+经过两步反应被氧化成NO3﹣.反应的能量变化示意图如下:
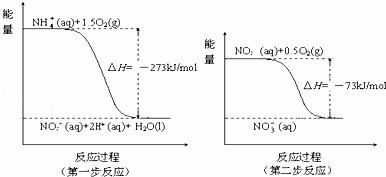
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
②1mol NH4+(aq)全部氧化成NO3﹣(aq)的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应mA(g)+nB(g)⇌pC(g),达到平时,测得c(A)为0.5mol•L﹣1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol•L﹣1.则下列判断正确的是()
A. 化学计量数:m+n>p B. 平衡向正反应方向移动了
C. 物质B的转化率减小了 D. 物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,摩托罗拉公司开始了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
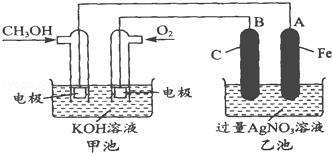
请填空:
(1)充电时:①原电池的负极与电源负极相连.②阳极的电极反应式为
(2)放电时,负极的电极反应式为
(3)在此过程中若完全反应,乙池中A极的质增加648g,则甲池中理论上消耗O2 L(标准状况下).
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B⇌3C+4D反应中,表示该反应速率最快的是()
A. υ(A)=0.5 mol/(L•s) B. υ(B)=1 mol/(L•s)
C. υ(C)=0.8 mol/(L•s) D. υ(D)=0.3 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 正反应是放热反应.若反应物起始的物质的量相等,下列关于该反应的示意图不正确的是()
A. 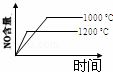 B.
B. 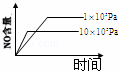 C.
C. 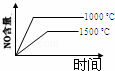 D.
D. 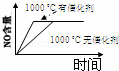
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是 ( )。
A.③①④② B.①③④②
C.④②①③ D.④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
列叙述错误的是()
A. NH3的喷泉实验说明氨气极易溶于水
B. NO 和NH3均可用排空气法收集
C. 盛液溴的瓶内加少量水可防止液溴的挥发
D. NH3遇到挥发性的强酸就能冒白烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com