
甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为________,甲醇分子内的O—C—H键角________(填“大于”、“等于”或“小于”)甲醛分子内的O—C—H键角。
科目:高中化学 来源: 题型:
1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理________,哪些违反了洪特规则____________________。

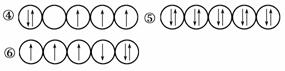
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为____________________________;其最高价氧化物对应的水化物的化学式是________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:2s 3d 4s 3s 4p 3p
轨道能量由低到高排列顺序是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
C.H2SO4分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有1个σ键、2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
1 mol乙醛分子中含有σ键的数目为________,乙酸的沸点明显高于乙醛,其主要原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象中,能用键能大小解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,而硫酸难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
如图甲是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是 ( )。

| 卡片号:2 2012.8.15 实验后的记录: ①Cu为阳极,Zn为阴极 ②Cu极上有气泡产生 ③SO42-向Cu极移动 ④若有0.5 mol电子流经导线,则可产生0.25 mol气体 ⑤电子的流向是:Cu→导线→Zn ⑥正极反应式:Cu+2e-===Cu2+ |
图乙
A.①②③ B.②④
C.④⑤⑥ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | — |
| 最低负价 | — | -1 | — | — | -3 | -2 |
下列说法中正确的是( )
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Y、M的单质分别与水反应,Y最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com