
| 0.4mol |
| 5 |
| 5mol×2.0×10-6mol |
| 2.0×10-3mol×2mol |


科目:高中化学 来源: 题型:
| A、110g |
| B、110g/mol |
| C、55g/mol |
| D、55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个甘氨酸分子中存在10对共用电子 |
| B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
| C、维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
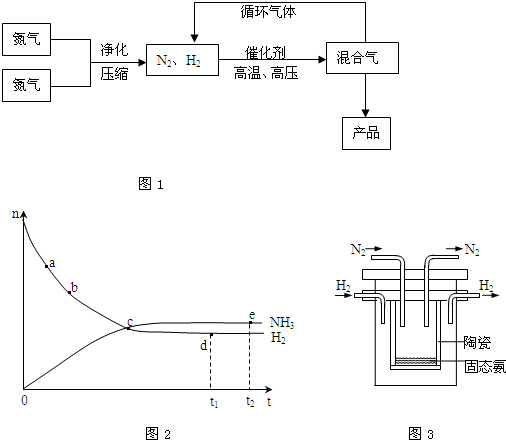
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:
俗话说“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室,我们可以用下图所示的装置来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
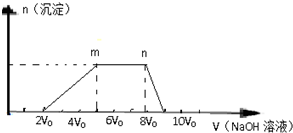 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com