
| A. | 抗氧化剂 | B. | 调味剂 | C. | 着色剂 | D. | 增稠剂 |
分析 一般来说,食品中常加入抗氧剂、调味剂、着色剂以及增稠剂等,其中加入抗氧化剂可减缓食品的腐蚀,延长保质期,而调味剂、着色剂以及增稠剂与食品的色、态、味有关,以此解答该题.
解答 解:A.抗氧化剂减少食品与氧气的接触,延缓氧化的反应速率,故A正确;
B.调味剂是为了增加食品的味道,与速率无关,故B错误;
C.着色剂是为了给食品添加某种颜色,与速率无关,故C错误;
D.增稠剂是改变物质的浓度,与速率无关,故D错误.
故选A.
点评 本题考查常见食品的添加剂,与化学反应速率相结合综合考查学生的双基以及分析能力,侧重于化学与生活的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
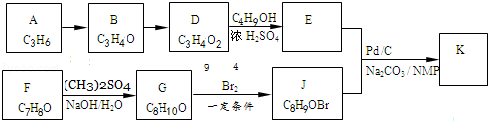
 .
.  ;K
;K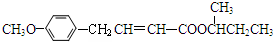 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 有机物 | A | B | C |
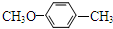
| 结构(分子式)及性质 |  ,水解生成B和C ,水解生成B和C | 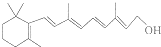 | ①分子式为C7H6O3; ②遇FeCl3水溶液呈紫色 ③与NaHCO3溶液反应产生CO2气体. |

 、
、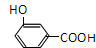 .
.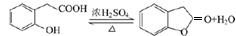 ;
;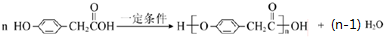 .
.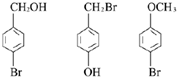 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a与其他三种元素形成的二元化合物中其化合价均为+1 | |
| B. | b与其他三种元素均可形成至少两种二元化合物 | |
| C. | c的原子半径是这些元素中最大的 | |
| D. | d与a形成的化合物的溶液呈弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | B. | 由乙烯生成乙醇属于加成反应 | ||
| C. | C4H9Cl有3种同分异构体 | D. | 油脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
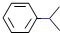
| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯的沸点比苯高 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯和苯为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
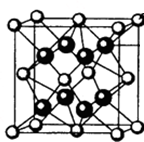 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com