
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如图:

回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是___。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有___溶液的烧杯中,充分搅拌后经___、___(填操作方法)可得纯净的Mg(OH)2。
(3)如图是该兴趣小组设计进行过程③的实验装置图:

其中装置A的作用是____。
(4)写出过程④中发生反应的化学方程式___。
【答案】石灰乳原料丰富,成本低 MgCl2(或氯化镁) 过滤 洗涤 制备干燥的HCl气体 MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
由题给流程图可知,向盐卤中加入石灰乳,海水中镁离子与石灰乳反应生成氢氧化镁,过滤得到氢氧化镁沉淀;从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀;向氢氧化镁中加入盐酸,氢氧化镁与盐酸反应氯化镁;过程②降温结晶得到MgCl26H2O,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl26H2O受热产生的水气,所以过程③在氯化氢气流中干燥产物得到无水氯化镁,过程④电解无水氯化镁得到镁。
(1)由于海边存在大量贝壳,贝壳煅烧得到生石灰,生石灰加水得到石灰乳,所以工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是石灰乳原料丰富,成本低,故答案为:石灰乳原料丰富,成本低;
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有MgCl2溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2,故答案为:MgCl2;过滤;洗涤;
(3)过程③在氯化氢气流中干燥产物得到无水氯化镁,浓硫酸稀释放热,氯化氢具有挥发性,所以图中浓盐酸滴加到浓硫酸中有氯化氢气体产生,氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,所以其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解,故答案为:制备干燥的HCl气体;
(4)过程④为电解熔融氯化镁得到镁和氯气,反应的化学方程式为MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
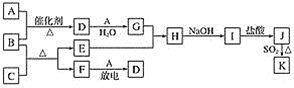
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
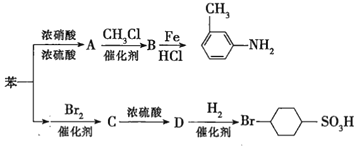
(1)![]() 是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为
是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为![]() 的化学方程式是______。
的化学方程式是______。
(2)在“苯![]() ”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
(3)有机物![]() 苯环上的二氯代物有__________种结构;
苯环上的二氯代物有__________种结构;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜
、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜![]() 含杂质
含杂质![]() 为原料,一种制备铜的氯化物的流程如下:
为原料,一种制备铜的氯化物的流程如下:
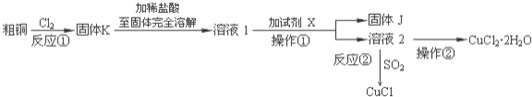
(1)上述流程中固体K溶于稀盐酸的目的是 ______ ![]() 试剂X、固体J的物质分别为 ______ .
试剂X、固体J的物质分别为 ______ .
A.NaOH![]() B.CuO
B.CuO![]() C.
C.![]()
![]()
![]()
![]()
(2)反应②是向溶液2中通入一定量的![]() ,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( )
A.NaOH、NaCl、NaAlO2B.KNO3、NaCl、CH3COONa
C.Na2S、(NH4)2SO3、AgNO3D.KNO3、Na2SO3、NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。
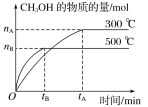
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:
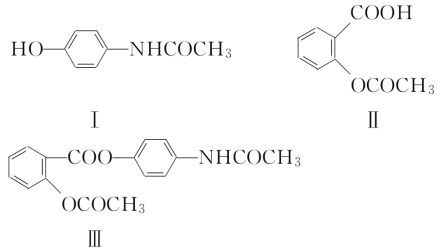
试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com