
| A. | 难溶的共价化合物 | B. | 是离子化合物 | ||
| C. | 是一种强电解质 | D. | 具有较强氧化性 |
分析 HgCl2在熔融状态下不能导电,属于共价化合物,晶体熔点较低,属于分子晶体,在水溶液中可发生微弱电离,属于弱电解质,据此结合选项判断.
解答 解:A、HgCl2在熔融状态下不能导电,难溶于水属于共价化合物,故A正确;
B、HgCl2在熔融状态下不能导电,属于共价化合物,不含离子键,故B错误;
C、HgCl2在熔融状态下不能导电,故属于共价化合物,HgCl2难溶于水,易溶于氯化钠饱和溶液中,HgCl2在溶液中可发生微弱电离,属于弱电解质,故C错误;
D、医院里用HgCl2的稀溶液用作手术刀的消毒剂,具有较强的氧化性,故D正确;
故选BC.
点评 本题考查物质晶体类型与性质关系,难度中等,注意掌握各类晶体类型构成微粒、微粒间作用、性质等.


科目:高中化学 来源: 题型:选择题
| A. | 由0.1mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| B. | 由10mLpH=3的CH3COOH溶液与1 mL pH=11的NaOH溶液混合而成 | |
| C. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| D. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中只存在非极性共价键 | |
| B. | 干冰升华时,分子内共价键会发生断裂 | |
| C. | 由原子构成的晶体可以是原子晶体,也可以是分子晶体 | |
| D. | 只要含有金属阳离子的晶体就一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 金属单质跟酸反应,一定放出氢气 | |
| C. | 元素从化合态变为游离态时,一定被氧化 | |
| D. | 元素从化合态变为游离态时,一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Al3+、Br- | B. | Na+、K+、SiO32-、CO32- | ||
| C. | Ca2+、Mg2+、NO3-、Cl- | D. | K+、NH4+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
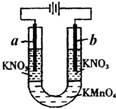 如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①④ | C. | ①②③ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com