
ĻĀĶ¼Į½øö×°ÖĆÖŠ£¬ŅŗĢåĢå»ż¾łĪŖ200 mL£¬æŖŹ¼¹¤×÷Ē°µē½āÖŹČÜŅŗµÄÅØ¶Č¾łĪŖ0.5 mol/L£¬¹¤×÷Ņ»¶ĪŹ±¼äŗ󣬲āµĆÓŠ0.02 molµē×ÓĶعż£¬ČōŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ

ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®²śÉśĘųĢåĢå»ż ¢Ł=¢Ś
B£®¢ŁÖŠŅõ¼«ÖŹĮæŌö¼Ó£¬¢ŚÖŠÕż¼«ÖŹĮæ¼õŠ”
C£®ČÜŅŗµÄpH±ä»Æ£ŗ¢Ł¼õŠ”£¬¢ŚŌö“ó
D£®µē¼«·“Ó¦Ź½£ŗ¢ŁÖŠŃō¼«£ŗ4OH£ - 4e£ = 2H2O+O2”ü ¢ŚÖŠøŗ¼«£ŗ2H++2e£=H2”ü
C
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA”¢¢ŁŹĒµē½ā³Ų£¬Į½¼«·Ö±š²śÉśCuŗĶŃõĘų£¬Ņõ¼«£ŗCu2++2e-==Cu £¬Ńō¼«£ŗ2H2O -4e- =O2”ü+4H+£¬µ±Ķعż0.02molµē×ÓŹ±£¬Éś³ÉŃõĘų0.02mol/4=0.005mol£»¢ŚŹĒŌµē³Ų£¬Zn×÷øŗ¼«£¬·¢ÉśZn-2e-=Zn2+£¬Cu×÷Õż¼«£¬·¢Éś2H++2e-==H2”ü£¬µ±Ķعż0.02molµē×ÓŹ±£¬Éś³ÉĒāĘųµÄĪļÖŹµÄĮæŹĒ0.01mol£¬¢ŁÓė¢Ś²śÉśµÄĘųĢå²»ĻąµČ£¬“ķĪó£»B”¢¢ŁÖŠŅõ¼«ÓŠCuĪö³ö£¬ÖŹĮæŌö¼Ó£»¢ŚÖŠÕż¼«ŹĒĒāĄė×ÓÉś³ÉĒāĘų£¬µē¼«ÖŹĮæ²»±ä£¬“ķĪó£»C”¢¢ŁÖŠŹĒĒāŃõøłĄė×ӷŵē£¬Éś³ÉŃõĘųŗĶĒāĄė×Ó£¬ĖłŅŌČÜŅŗpH¼õŠ”£¬¢ŚÖŠĒāĄė×ӷŵēÉś³ÉĒāĘų£¬ĒāŃõøłĄė×ÓÅضČŌö“ó£¬ĖłŅŌČÜŅŗpHŌö“ó£¬ÕżČ·£»D”¢¢ŚŹĒŌµē³Ų£¬Zn×÷øŗ¼«£¬·¢ÉśZn-2e-=Zn2+£¬“ķĪ󣬓š°øŃ”C”£
æ¼µć£ŗæ¼²éŌµē³Ų”¢µē½ā³ŲµÄÅŠ¶Ļ£¬·“Ó¦ŌĄķµÄÓ¦ÓĆ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ°²»ÕŹ”½ÄĻŹ®Š£øßČżÉĻѧʌʌĩĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
(14·Ö)Ēā»ÆøĘ(CaH2)ŹĒ¶žÖÖ³£ÓƵē¢Ēā²ÄĮĻ£¬Ņ²ŹĒµĒɽŌĖ¶ÆŌ±³£ÓƵÄÄÜŌ“Ģį¹©¼Į£¬ŠčŅŖĆÜ·ā±£“ę£¬ÓöĖ®·“Ӧɜ³ÉĒāŃõ»ÆøĘŗĶĒāĘų”£Ä³ŃŠ¾æŠŌѧĻ°Š”×éÄ£ÄāÉś²śĘóŅµÖĘČ”Ēā»ÆøĘ”£
”¾ŹµŃé”æ
ÓĆŠæĮ£ŗĶĻ”ĮņĖį·“Ó¦ÖʵĆøÉŌļ”¢“æ¾»µÄĒāĘų£¬ŌŁÓė½šŹōøĘŌŚ¼ÓČȵÄĢõ¼žĻĀÖ±½Ó»ÆŗĻ£¬¼“æÉÖʵĆCaH2”£
£Ø1£©ĻĀĮŠÓŠ¹ŲøĆŹµŃéµÄĖµ·ØÕżČ·µÄŹĒ ”£
a£®ĘäĖūĢõ¼žĻąĶ¬Ź±£¬“ÖŠæÖĘČ”ĒāĘųµÄĖŁĀŹ±Č“æŠææģ
b£®¼ÓČČŹ±£¬±ŲŠėĶØČėµŖĘų×÷ĪŖ±£»¤Ęų£¬ŅŌ·ĄÖ¹æÕĘųµÄøÉČÅ
c£®æÉŅŌÓĆÅØĮņĖį»ņ¼īŹÆ»Ņ¶ŌH2½ųŠŠøÉŌļ³żŌÓ
d£®æŖŹ¼ŹµŃ鏱£¬Ó¦ĻČĶØČėH2£¬ŗóøų½šŹōøĘ¼ÓČČ
e£®ŅŃĶ£Ö¹ŹµŃ鏱£¬Ó¦ĻČĶ£Ö¹ĶØČėH2£¬ŗóĶ£Ö¹¼ÓČČ”£
”¾Ģį³ö¼ŁÉč”æ
£Ø2£©ÓÉÓŚŹµŃéÖŠ²Ł×÷²»µ±£¬½šŹōøĘ»ņĒā»Æøʶ¼æÉÄܱ»Ńõ»Æ”£øĆŠ”×é¼×Ķ¬Ń§¶Ō·“Ó¦ŗóµÄ¹ĢĢå²śĪļ³É·ÖĢį³öČēĻĀ¼ŁÉč”£
¼ŁÉčl£ŗŗ¬ÓŠCa ŗĶCaH2”£
¼ŁÉč2£ŗŗ¬ÓŠCaH2ŗĶCaO”£
¼ŁÉč3£ŗŗ¬ÓŠ ”£
”¾Éč¼ĘŹµŃé·½°ø£¬ŃéÖ¤¼ŁÉč”æ
£Ø3£©¶ØŠŌŹµŃéÓĆ»Æѧ·½·Ø¼ų±šCaÓėCaH2£¬ĒėÉč¼ĘŹµŃéĶź³ÉĻĀ±ķÖŠÄŚČŻ”£
ŹµŃé²½Öč(²»ŅŖĒ󊓾ßĢå²Ł×÷¹ż³Ģ) | Ō¤ĘŚĻÖĻóŗĶ½įĀŪ |
ȔɣĮæ¹ĢĢåѳʷ£¬” |
£Ø4£©¶ØĮæŹµŃé ²ā¶ØCa ŗĶCaH2 »ģŗĻĪļÖŠCaH2 µÄÖŹĮæ·ÖŹż”£
¢ŁČ”m1gѳʷÓėĖ®ĶźČ«·“Ó¦£¬ĄūÓĆČēĶ¼×°ÖĆ²ā¶ØÉś³ÉµÄĘųĢåĢå»żŹ±£¬ŌŚ Ź±½ųŠŠŹÕ¼Æ£ØĢī×ÖÄø£©
a£®øÕæŖŹ¼ÓŠĘųÅŻŹ± b£®ĘųÅŻĮ¬Šų¾łŌČŹ± c£®ĘųĢå¾¹żŃé“æŗó£¬ŌŁŹÕ¼Æ

¢ŚČē¹ū×°ÖĆĘųĆÜŠŌĮ¼ŗĆ£¬²Ł×÷ÕżČ·£¬ŅŅĶ¬Ń§ČĻĪŖ£ŗÓÉÓŚŅŗĢå¼ÓČė£¬µ¼ÖĀĘųĢåµÄĢå»ż²ā¶ØĘ«“ó£¬Ōņ¼ĘĖć³öĒā»ÆøʵÄÖŹĮæ·ÖŹż £ØĢģ”°Ę«øß”±”¢”°Ę«µĶ”±”°ĪŽÓ°Ļģ”±£©
”¾·“Ė¼Óė½»Į÷”æ
£Ø5£©µĒɽŌĖ¶ÆŌ±³£ÓĆĒā»ÆøĘ×÷ĪŖÄÜŌ“Ģį¹©¼Į£¬ÓėĒāĘųĻą±Č£¬ĘäÓŵćŹĒĒā»ÆøĘŹĒ¹ĢĢ壬ŠÆ“ų·½±ć”£¼ČČ»½šŹōøĘÓėĖ®·“Ó¦Ņ²ÄÜÉś³ÉĒāĘų£¬ĪŖŹ²Ć“»¹ŅŖ½²½šŹōøĘÖʱø³ÉĒā»ÆøĘÄŲ£æÄćµÄ¹ŪµćŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015Äźŗž±±Ź”¾£ĆÅŹŠøßČżŌŖŌĀµ÷æ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©¼×ĆŃ£ØCH3OCH3£©±»³ĘĪŖ21ŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£¬ĖüĒå½ą”¢øߊ§”¢¾ßÓŠÓÅĮ¼µÄ»·±£ŠŌÄÜ£¬¼×ĆŃŹĒŅ»ÖÖĪŽÉ«ĘųĢ壬¾ßÓŠĒįĪ¢µÄĆŃĻćĪ¶£¬ĘäČ¼ÉÕČČĪŖ1455 kJ£Æmol£¬¼×ĆŃæÉ×÷Č¼ĮĻµē³ŲµÄČ¼ĮĻ”£
£Ø1£©Š“³ö¼×ĆŃČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ £»ŅŃÖŖH2£Øg£©ŗĶC£Øs£©µÄČ¼ÉÕČČ·Ö±šŹĒ285.8 kJ”¤mol-1”¢393.5 kJ”¤mol-1£»¼ĘĖć·“Ó¦4C£Øs£©+6H2£Øg£©+O2£Øg£©==2CH3OCH3 £Øg£©µÄ·“Ó¦ČČĪŖ £»
£Ø2£©¹¤ŅµÉĻĄūÓĆH2ŗĶCO2ŗĻ³É¶ž¼×Ćѵķ“Ó¦ČēĻĀ£ŗ6H2£Øg£©+2CO2£Øg£© CH3OCH3£Øg£©+3H2O£Øg£© ”÷H£¼0
CH3OCH3£Øg£©+3H2O£Øg£© ”÷H£¼0
¢ŁŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚŅ»øö¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£®ĻĀĮŠÄÜÅŠ¶Ļ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ
______£ØŃ”Ģī±ąŗÅ£¬×¢Ņā“󊔊“£©
a£®c£ØH2£©Óėc£ØH2O£©µÄ±ČÖµ±£³Ö²»±ä
b£®µ„Ī»Ź±¼äÄŚÓŠ2mol H2ĻūŗÄŹ±ÓŠ1mol H2OÉś³É
c£®ČŻĘ÷ÖŠĘųĢåĆÜ¶Č²»ŌŁøıä
d£®ČŻĘ÷ÖŠĘųĢåŃ¹Ēæ²»ŌŁøıä
¢ŚĪĀ¶ČÉżøߣ¬øĆ»ÆŃ§Ę½ŗāŅʶÆŗ󵽓ļŠĀµÄĘ½ŗā£¬CH3OCH3µÄ²śĀŹ½«
________£ØĢī”°±ä“ó”±”¢”°±äŠ””±»ņ”°²»±ä”±£¬ĻĀĶ¬£©£¬»ģŗĻĘųĢåµÄĘ½¾łŹ½Į潫__________£»
£Ø3£©ŅŌ¼×ĆŃ”¢æÕĘų”¢ĒāŃõ»Æ¼ŲČÜŅŗĪŖŌĮĻ£¬ŹÆÄ«ĪŖµē¼«æɹ¹³ÉČ¼ĮĻµē³Ų”£øƵē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖ____________________£»
£Ø4£©ÓĆ£Ø3£©ÖŠµÄČ¼ĮĻµē³ŲĪŖµēŌ“£¬ŅŌŹÆÄ«ĪŖµē¼«µē½ā500 mLµĪÓŠ·ÓĢŖµÄNaClČÜŅŗ£¬×°ÖĆČēĶ¼ĖłŹ¾£ŗ

ĒėŠ“³öµē½ā¹ż³ĢÖŠYµē¼«ø½½ü¹Ū²ģµ½µÄĻÖĻó £»µ±Č¼ĮĻµē³ŲĻūŗÄ2.8 LO2£Ø±ź×¼×“æöĻĀ£©Ź±£¬¼ĘĖć“ĖŹ±£ŗNaClČÜŅŗµÄpH= £Ø¼ŁÉčČÜŅŗµÄĢå»ż²»±ä£¬ĘųĢåČ«²æ“ÓČÜŅŗÖŠŅŻ³ö£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğÖŲĒģŹŠĘߊ£øßČżÉĻѧʌʌĩĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ £Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖ£ŗHCN£Øaq£©ÓėNaOH£Øaq£©·“Ó¦µÄ £»HCl£Øaq£©ÓėNaOH£Øaq£© ·“ Ó¦µÄ
£»HCl£Øaq£©ÓėNaOH£Øaq£© ·“ Ó¦µÄ £¬ŌņHCNŌŚĖ®ČÜŅŗÖŠµēĄėµÄ
£¬ŌņHCNŌŚĖ®ČÜŅŗÖŠµēĄėµÄ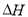 µČÓŚ
µČÓŚ
A£®
 B£®-43.5
B£®-43.5
C£®+43.5 D£®+67.7
D£®+67.7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğÕć½Ź”Š×÷ĢåøßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
£Ø14·Ö£©ÄÉĆ×Ģ¼ĖįøĘÓ¦ÓĆ·Ē³£¹ć·ŗ”£ŹµŃéŹŅÖŠĄūÓĆĻĀĶ¼ĖłŹ¾×°ÖĆ(²æ·Ö¼Š³Ö×°ÖĆŅŃĀŌČ„)£¬Ļņ±„ŗĶCaCl2ČÜŅŗÖŠĶØČėNH3ŗĶCO2æÉÖʵĆÄÉĆ×Ģ¼ĖįøĘ”£

¹©Ń”ŌńµÄŅ©Ę·£ŗ¢ŁŹÆ»ŅŹÆ ¢ŚĀČ»Æļ§ ¢ŪĒāŃõ»ÆøĘ ¢Ü±„ŗĶĀČ»ÆøĘČÜŅŗ
¢ŻÅØĮņĖį ¢Ž6 mol”¤L-1ŃĪĖį ¢ß±„ŗĶŹ³ŃĪĖ® ¢ą±„ŗĶNaHCO3ČÜŅŗ
£Ø1£©×°ÖĆAÖŠ£¬ŅĒĘ÷aµÄĆū³ĘŹĒ £¬ŅĒĘ÷bÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£×°ÖĆDµÄŹŌ¹ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£×°ÖĆBÖŠŹ¢·ÅµÄČÜŅŗŹĒ £ØĢīŅ©Ę·ŠņŗÅ£©”£
£Ø2£©Éč¼ĘŅ»øö¼ņµ„µÄŹµŃé·½°ø£¬ÅŠ¶ĻĖłµĆĢ¼ĖįøĘæÅĮ£ŹĒ·ńĪŖÄÉĆ×¼¶”£
”££Ø¼ņŹöŹµŃéµÄ²½Öč”¢ĻÖĻóŗĶ½įĀŪ£©
£Ø3£©ĶØČĖŹŹĮæĘųĢåŗó£¬C×°ÖĆÖŠĪļÖŹĒ”ŗĆĶźČ«·“Ó¦£¬¹żĀĖ£¬ĖłµĆĀĖŅŗĻŌ (Ģī”°Ėį”±”¢”°¼ī”±”¢”°ÖŠ”±Ö®Ņ»)ŠŌ£¬ŌŅņŹĒ £ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©”£
£Ø4£©ÉĻŹö×°ÖĆ“ęŌŚŅ»“¦Č±ĻŻ£¬øĆȱĻŻĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğÕć½Ź”Äž²ØŹŠøßČżŅ»ŌĀ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©
£Ø1£©20”ꏱ0.1 mol”¤L£1NaOH·Ö±šµĪ¶Ø0.1 mol”¤L£1HCl”¢0.1 mol”¤L£1CH3COOHµÄpH±ä»ÆĒśĻßČēĻĀ”£
øł¾ŻÉĻŹöĒśĻß»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł²āµĆ“×ĖįĘšµćpHĪŖ3£¬Ōņ20”ꏱøĆÅØ¶Č“×ĖįµÄµēĄė¶ČĪŖ £»
¢ŚµĪ¶ØæŖŹ¼ŗó“×ĖįĒśĻß±ä»Æ±ČŃĪĖįæģµÄŌŅņŹĒ £»
£Ø2£©25 ”ꏱ0.1 mol”¤L-1µÄH2RĖ®ČÜŅŗÖŠ£¬ÓĆĒāŃõ»ÆÄĘĄ“µ÷½ŚČÜŅŗpH£¬µĆµ½ŗ¬ÓŠH2R”¢HR£”¢R2£ČżÖÖĪ¢Į£µÄČÜŅŗ”£µ±c(Na+)=c(R2£)+c(HR£)+c(H2R)Ź±ČÜŅŗµÄČÜÖŹĪŖ (Ģī»ÆѧŹ½)”£
£Ø3£©ĻĀĶ¼ŹĒijĖ®ČÜŅŗŌŚpH“Ó0ÖĮ14µÄ·¶Ī§ÄŚH2CO3”¢HCO3£”¢CO32£ČżÖֳɷÖĘ½ŗāŹ±µÄ×é³É·ÖŹż”£
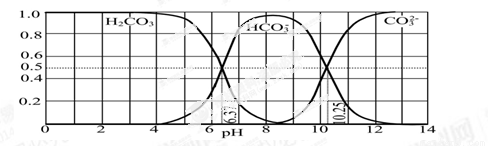
¢ŁĻĀĮŠŠšŹöÕżČ·µÄŹĒ ”£
A£®“ĖĶ¼ŹĒ1.0 mol”¤L£1Ģ¼ĖįÄĘČÜŅŗµĪ¶Ø1.0 mol”¤L£1 HClČÜŅŗµÄµĪ¶ØĒśĻß
B£®ŌŚpH·Ö±šĪŖ6.37¼°10.25Ź±£¬ČÜŅŗÖŠc(H2CO3)=c(HCO3£)=c(CO32£)
C£®ČĖĢåŃŖŅŗµÄpHŌ¼ĪŖ7.4£¬ŌņCO2ŌŚŃŖŅŗÖŠ¶ąŅŌHCO3£ŠĪŹ½“ęŌŚ
D£®ČōÓĆCO2ŗĶNaOH·“Ó¦ÖĘČ”NaHCO3£¬ŅĖæŲÖĘČÜŅŗµÄpHĪŖ7”«9Ö®¼ä
£Ø4£©½«ÄņĖŲŹ©ČėĶĮČĄŗ󣬓ó²æ·ÖŹĒĶعż×Ŗ»ÆĪŖĢ¼Ėįļ§»ņĢ¼ĖįĒāļ§ŗó²Å±»×÷ĪļĖłĄūÓĆ£¬ÄņĖŲ·Ö×ÓŌŚĪ¢ÉśĪļ·ÖĆŚµÄėåĆø×÷ÓĆĻĀ£¬×Ŗ»ÆĪŖĢ¼Ėįļ§”£ŅŃÖŖČõµē½āÖŹŌŚĖ®ÖŠµÄµēĄėĘ½ŗā³£Źż£Ø25”ę£©ČēĻĀ±ķ£ŗ
Čõµē½āÖŹ | H2CO3 | NH3”¤H2O |
µēĄėĘ½ŗā³£Źż | Ka1£½4.30”Į10-7 Ka2£½5.61”Į10-11 | 1.77”Į10-5 |
ĻÖÓŠ³£ĪĀĻĀ0.1 mol”¤L-1µÄ(NH4)2CO3ČÜŅŗ£¬
¢ŁÄćČĻĪŖøĆČÜŅŗ³Ź ŠŌ£ØĢī”°Ėį”±”¢”°ÖŠ”±”¢”°¼ī”±£©£¬ŌŅņŹĒ ”£
¢Ś¾ĶøĆČÜŅŗÖŠĮ£×ÓÖ®¼äÓŠĻĀĮŠ¹ŲĻµŹ½£¬ÄćČĻĪŖĘäÖŠÕżČ·µÄŹĒ ”£
A£®c (NH4+)£¾c (CO32-)£¾c (HCO3-)£¾c (NH3”¤H2O)
B£®c(NH4+)+c(H+)£½c(HCO3-)+c(OH-)+c(CO32-)
C£®c (CO32-) + c (HCO3-) +c (H2CO3)£½0.1 mol”¤L-1
D£®c (NH4+)+ c (NH3”¤H2O)£½2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğÕć½Ź”Äž²ØŹŠøßČżŅ»ŌĀ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
µē½ā×°ÖĆČēĶ¼ĖłŹ¾£¬µē½ā²ŪČװӊKI¼°µķ·ŪČÜŅŗ£¬ÖŠ¼äÓĆŅõĄė×Ó½»»»Ä¤øōæŖ”£ŌŚŅ»¶ØµÄµēŃ¹ĻĀĶصē£¬·¢ĻÖ×ó²ąČÜŅŗ±äĄ¶É«£¬Ņ»¶ĪŹ±¼äŗó£¬Ą¶É«Öš½„±äĒ³”£ŅŃÖŖ£ŗ3I2£«6OH£===IO£«5I££«3H2O£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®ÓŅ²ą·¢ÉśµÄµē¼«·“Ó¦Ńõ»Æ·“Ó¦
B£®µē½ā½įŹųŹ±£¬ÓŅ²ąČÜŅŗÖŠŗ¬ÓŠIO3-
C£®µē½ā²ŪÄŚ·¢Éś·“Ó¦µÄ×Ü»Æѧ·½³ĢŹ½£ŗ2KI£«2H2O KOH£«H2”ü+I2
KOH£«H2”ü+I2
D£®Čē¹ūÓĆŃōĄė×Ó½»»»Ä¤“śĢęŅõĄė×Ó½»»»Ä¤£¬µē½ā²ŪÄŚ·¢ÉśµÄ×Ü»Æѧ·“Ó¦²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğÕć½Ź”ŗ¼ÖŻµŲĒų7Š£øßČżÉĻŃ§ĘŚĘŚÄ©Ä£ÄāĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
£Ø7·Ö£©²ŻĖį¾§ĢåµÄ×é³ÉæɱķŹ¾ĪŖ£ŗH2C2O4”¤xH2O£¬ŹµŃéŹŅ³£ÓĆĘä¼ÓČČ·Ö½āÖĘČ”COĘųĢ壬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗH2C2O4”¤xH2O  CO”ü£«CO2”ü£«£Øx+1£©H2O£¬½«Éś³ÉµÄCO2ŗĶĖ®ÕōĘų³żµō£¬¼“µĆµ½½Ļ“æ¾»µÄCOĘųĢ唣
CO”ü£«CO2”ü£«£Øx+1£©H2O£¬½«Éś³ÉµÄCO2ŗĶĖ®ÕōĘų³żµō£¬¼“µĆµ½½Ļ“æ¾»µÄCOĘųĢ唣
¢ń”¢ĻĀĶ¼ŹĒ³żČ„²ŻĖį·Ö½ā²śĪļÖŠµÄCO2”¢Ė®ÕōĘųŗóµĆµ½CO£¬²¢ÓĆCO»¹ŌĮ½ĶعÜÖŠµÄCuOŹµŃé×°ÖĆ£¬»Ų“šĻĀĮŠĪŹĢā”£

£Ø1£©ŌŚ¼×Ļ“ĘųĘæÖŠĖłŹ¢ČÜŅŗŹĒ ”£
£Ø2£©CuOČ«²æ±»»¹ŌŗóĶ£Ö¹ŹµŃé²Ł×÷µÄ²½ÖčµÄÓŠ£ŗ¢ŁĶ£Ö¹ĶØĘųĢ壬¢ŚĻØĆš¾Ę¾«µĘ£¬¢Ū²šĻĀŹµŃé×°ÖĆ£¬¢Ü¼ĢŠųĶØĘųĢåµ½Į½ĶØ¹ÜĄäČ“Ö¹”£ĘäÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ ”£
A£®¢Ü¢Ś¢Ł¢Ū B£®¢Ł¢Ś¢Ū C£®¢Ś¢Ü¢Ł¢Ū D£®¢Ś¢Ü¢Ū
¢ņ”¢ĪŖ²ā¶Ø²ŻĖį¾§ĢåµÄxÖµ£¬½ųŠŠĻĀĮŠŹµŃé£ŗ
¢ŁČ”wg²ŻĖį¾§ĢåÅä³É100mLĖ®ČÜŅŗ£»
¢ŚĮæČ”25.00mL²ŻĖįČÜŅŗÖĆӌ׶ŠĪĘæÖŠ£¬¼ÓČėŹŹĮæĻ”H2SO4ŗó£¬ÓĆÅضČĪŖc mol”¤L-1KMnO4ČÜŅŗµĪ¶Ø”£µĪ¶ØŹ±£¬Ėł·¢ÉśµÄ·“Ó¦ĪŖ£ŗ2KMnO4£«5H2C2O4£«3H2SO4£½K2SO4£«10CO2”ü£«2MnSO4£«8H2O
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹµŃé¢ŚÖŠ£¬µĪ¶ØŹ±£¬KMnO4ČÜŅŗӦװŌŚ £ØĢī”°ĖįŹ½µĪ¶Ø¹Ü”±”¢”°¼īŹ½µĪ¶Ø¹Ü”±£©ÖŠ”£
£Ø2£©ÅŠ¶ĻµĪ¶ØÖÕµćµÄ·½·ØŹĒ ”£ČōµĪ¶ØŹ±£¬Ē°ŗóĮ½“Ī¶ĮŹż·Ö±šĪŖa mLŗĶb mL£¬ÓÉ“Ė¼ĘĖć³öøĆ²ŻĖį¾§ĢåµÄxÖµŹĒ ”£
£Ø3£©ĻĀĮŠ²Ł×÷»įŅżĘš²āµĆµÄxֵʫ“óµÄŹĒ £ØĢīŃ”Ļī£©
A£®µĪ¶Ø½įŹųŹ±ø©ŹÓ¶ĮŹż
B£®µĪ¶Ø½įŹųŗóµĪ¶Ø¹Ü¼ā×ģ“¦»¹ÓŠŅ»µĪ±ź×¼ŅŗŠü¶ųĪ“µĪ
C£®×¶ŠĪĘæĪ“øÉŌļ¼“×°Čė²ŻĖįČÜŅŗ
D£®µĪ¶Ø¹ÜÓĆÕōĮóĖ®Ļ“¾»ŗó¼“×°ČėKMnO4ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğŗžÄĻŹ”ŅęŃōŹŠøßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆNA±ķŹ¾°¢·üµĀĀŽ³£Źż£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A£®±ź×¼×“æöĻĀ£¬22.4LH2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ NA
B£®³£ĪĀ³£Ń¹ĻĀ£¬1.06g Na2CO3ŗ¬ÓŠµÄNa+Ąė×ÓŹżĪŖ0.02 NA
C£®Ķس£×“æöĻĀ£¬NAøöCO2·Ö×ÓÕ¼ÓŠµÄĢå»żĪŖ22.4L
D£®ĪļÖŹµÄĮæÅضČĪŖ0.5 mol/LµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl-øöŹżĪŖ NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com