
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n+5 |
分析 根据化合物X2Y3,则X元素的化合价为+3价,Y元素的化合价为-2价,则X可能为B或Al元素,Y可能为O或S元素,还存在特殊情况为X为N元素,Y为O元素形成的化合物.
解答 解:A、若化合物X2Y3为B2S3,B的核电荷数为5,S的为16,已知X的核电荷数为n,则Y的核电荷数为n+11,故A有可能;
B、若化合物X2Y3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-5,故D有可能;
C、若化合物X2Y3为Al2S3,Al的核电荷数为13,S的为16,已知X的核电荷数为n,则Y的核电荷数为n+3,故C有可能;
D.若化合物Y2X3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-5,故D不可能;
故选D.
点评 本题考查学生利用化合价与化学式及核电荷数的关系,学生应熟悉常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则来分析解答.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3组成元素相同,与H2O反应产物也相同 | |
| B. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| C. | CO、NO、NO2都能形成光化学烟雾,是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解) | |
| B. | 1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子 | |
| C. | 在该溶液中,K+、NH4+、I-、SO42-可以大量共存 | |
| D. | 与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
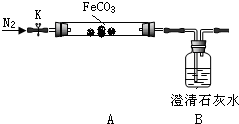
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单体CH2═CH2制高聚物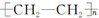 | B. | 单体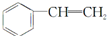 与CH2═CH-CHCH2 与CH2═CH-CHCH2制高聚物 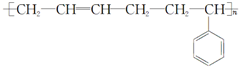 | ||
| C. | 单体CH2═CH-CH3与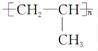 | D. | 单体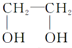 与 与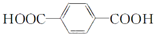 制高聚物 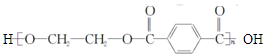 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com