
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是
_______(填序号)。
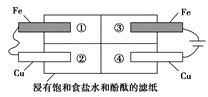
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2OCH3CH2OH+CH3COOH
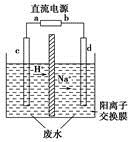
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入________(填化学式),电极反应式为________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
(1)2Cu+H2O-2e-=Cu2O+2H+ 2H++2e-=H2↑ (2)d (3)①CH4 CH4-8e-+10OH-=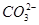 +7H2O 不变 ②1.9
+7H2O 不变 ②1.9
【解析】 (1)由于阳极材料为铜,所以铜本身失电子被氧化,由题意知氧化产物为Cu2O,可得阳极反应式为2Cu+H2O-2e-=Cu2O+2H+,阴极上阳离子放电,即溶液中H+被还原成清洁能源H2。
(2)左半区是原电池装置,发生的是铁的吸氧腐蚀,负极(Fe):Fe-2e-=Fe2+,正极(Cu):O2+2H2O+4e-=4OH-。右半区是电解装置,阳极(Fe):Fe-2e-=Fe2+,阴极(Cu):2H++2e-=H2↑,由于电解引起腐蚀的速率远大于吸氧腐蚀的速率,因此最先观察到变成红色的区域是④区,故选项a、b、c均错误。
(3)①根据电解液中阳离子的迁移方向,可知c为阳极,d为阴极,因此直流电源上a为正极,通入O2,b为负极,通入CH4,在碱性条件下CH4的氧化产物为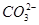 ,由此可写出此电极的电极反应式。在电解过程中,由于
,由此可写出此电极的电极反应式。在电解过程中,由于 没有参与放电,且阳离子交换膜不允许阴离子自由通过,因此根据质量守恒可得阴极区Na2SO4的物质的量不变。
没有参与放电,且阳离子交换膜不允许阴离子自由通过,因此根据质量守恒可得阴极区Na2SO4的物质的量不变。
②阴极区发生还原反应,即CH3CHO转化成CH3CH2OH,设生成的乙醇为x kg,根据碳原子守恒可得关系式:
CH3CHO ~ CH3CH2OH
44 46
3 000×103÷106×60% x
解得x≈1.9。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表,下列判断不正确的是
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) = Kw/10-9mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
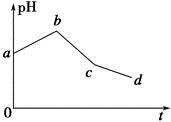
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
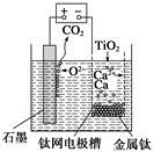
A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
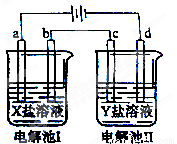
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学甲烷、乙烯及其同系物、苯及其同系物(解析版) 题型:选择题
下列说法中正确的是
A.1 mol蔗糖可以水解生成2 mol葡萄糖
B.甲苯(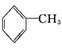 )的一氯取代物有4种
)的一氯取代物有4种
C.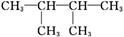 的一氯取代物有4种(不考虑空间异构)
的一氯取代物有4种(不考虑空间异构)
D.CH3—CH CH—CH3与C4H8互为同系物
CH—CH3与C4H8互为同系物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:选择题
某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验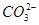 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果的准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸根离子能完全转化为沉淀。
其中正确的是
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com