
| A. | 道尔顿提出原子学说,门捷列夫发现元素周期律 | |
| B. | 化学研究的主要目的就是认识分子 | |
| C. | 研究物质的性质,常常运用观察、实验、分类、比较等方法 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
分析 A.道尔顿提出近代原子学说;门捷列夫整理出了元素周期表;
B.化学的研究目的是帮助人们认识、改造和应用物质;
C.化学研究的基本方法有:观察、实验、分类、比较等方法,除此之外,建立假说和化学模型在研究物质的结构和性质时也起着重要的作用;
D.化学家可以在微观层面上操纵分子和原子.
解答 解:A.道尔顿提出了近代原子学说,门捷列夫整理了元素周期表,提出了元素周期律,故A正确;
B.化学的研究目的是帮助人们认识、改造和应用物质,不是认识分子,故B错误;
C.观察、实验、分类、比较等是研究物质性质的基本方法,故C正确;
D.科学的发展非常迅速,化学家可以在微观层面上操纵分子和原子,从而用分子或原子来组装分子材料、分子器件和分子机器,故D正确.
故选B.
点评 本题考查了化学研究的基本方法和作用,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:

(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蛋白质、油脂都是高分子化合物 | |
| B. | 糖类、蛋白质、油脂都是由C、H、O三种元素组成的 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 只用淀粉溶液就可鉴别市售食盐是否为加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小(除H2O外) | ||
| C. | 溶液中离子数目增多 | D. | $\frac{c(N{a}^{+})}{c(C{O}_{3}^{2-})}$比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向沸腾的蒸馏水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C | 检验溶液中是否含有SO42- | 取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
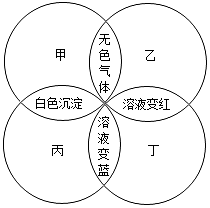 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:
甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com