
分析 (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)根据适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,据此书写热化学方程式;
(3)①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
依据盖斯定律,①+②-2×③计算.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1;
(3)①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
依据盖斯定律,①+②-2×③得到:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol,
故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol.
点评 本题主要考查了热化学方程式的书写,注意盖斯定律的应用,把握热化学方程式的意义,难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
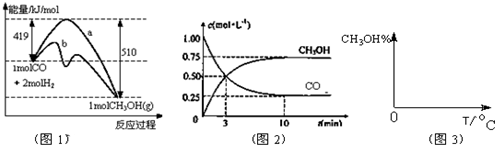
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
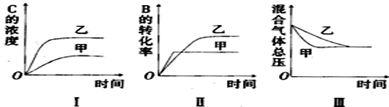
| A. | 图I研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的可能是压强对反应的影响,且甲的压强较高 | |
| C. | 图Ⅱ研究的可能是温度对反应的影响,且甲的温度较高 | |
| D. | 图Ⅲ研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
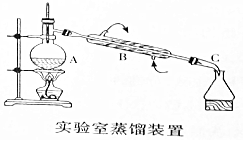 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,一种元素被氧化,一定是另一种元素被还原 | |
| B. | 某元素由化合态变成游离态,此元素可能被氧化,也可能被还原 | |
| C. | 金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com