
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(N2O4 2NO2 △H > 0)
2NO2 △H > 0)
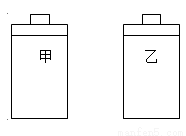
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙 B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙 D.(a)甲>乙,(b)甲<乙
科目:高中化学 来源:2016-2017学年辽宁省高二上第一次月考化学试卷(解析版) 题型:选择题
有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次学段考试化学卷(解析版) 题型:实验题
下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,实验操作如下,
①将配好的稀硫酸倒入试剂瓶中,贴好标签;
②盖好容量瓶塞,反复颠倒摇匀;
③用量筒量取 ml的98% 的浓硫酸;
④将浓硫酸稀释;
⑤用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑥将已冷却至室温的硫酸溶液沿玻璃棒注入 __________;
⑦改用__________ 逐滴加蒸馏水,使溶液的____________ 正好跟刻度相平。
⑧继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
请完成下列问题:
(1)正确操作步骤的顺序是(填序号)③④ ⑦②①
(2)③中所需浓硫酸的体积 ml,⑥中所需仪器名称是 。
(3)简述④中浓硫酸的稀释方法 。
(4)完成⑦中的填空 、 。
(5)若在操作中没有把少量洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度(填“大于”、“小于”或“等于”) 0.5mol/L,配制成稀H2SO4时若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”) 0.5mol/L.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:填空题
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) △H=-dkJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) △H=-dkJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
(1)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2) 。
(2)该温度下此反应的平衡常数K的值为 。
(3)三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1
B.Q1+Q2=d
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
(4)在其他条件不变的情况下,在第5min将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。
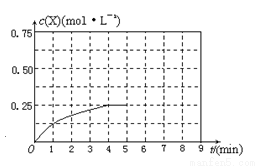
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是
2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是
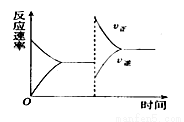
A.温度、压强不变,充入一些A2(g)
B.压强不变,降低温度
C.压强、温度不变,充入一些与之不反应的惰性气体
D.升高温度,同时加压
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上第一次月考化学试卷(解析版) 题型:选择题
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) △H=-2834.9 kJ/mol;
②4Al(s)+2O3(g)=2Al2O3(s) △H=-3119.1 kJ/mol。由此得出的正确结论是
A.等质量的O2比O3的能量低,由O2变O3为放热反应
B.等质量的O2比O3的能量高,由O2变O3为吸热反应
C.O2比O3稳定,3O2(g)=2O3(g) △H=-284.2 kJ/mol
D.O2比O3稳定,3O2(g)=2O3(g) △H=+284.2 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:实验题
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。

(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。

查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:选择题
建设“碧水蓝天”的生态城市,下列措施中不合理的是
A.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
B.积极推广太阳能、风能等新能源的使用,减少化石燃料的使用
C.加强城市生活污水脱氮除磷处理,遏制水体富营养化
D.加高烟囱,减少烟尘对周围环境的影响
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com