
【题目】按要求写出下列反应方程式(请注明反应条件),并按要求填空
(1)实验室制备乙烯_______________,反应类型是___________.
(2)乙酸与乙醇的反应______________,反应的无机产物中氧元素的来源是________。
(3)溴乙烷与氢氧化钠水溶液共热_____________,此反应将卤代烃类物质转化为______类物质.
(4)苯与浓硫酸、浓硝酸的混合酸在加热时发生反应__________,反应类型是___________.
【答案】CH3CH2OH![]() CH2=CH2↑+H2O 消去反应 CH3COOH+CH3CH2OH
CH2=CH2↑+H2O 消去反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 乙酸 CH3CH2Br+NaOH
CH3COOCH2CH3+H2O 乙酸 CH3CH2Br+NaOH![]() CH3CH2OH+NaBr 醇
CH3CH2OH+NaBr 醇 ![]() +HNO3
+HNO3![]()
![]() +H2O 取代反应
+H2O 取代反应
【解析】
(1)实验室用加热乙醇和浓硫酸混合物的方法制备乙烯;(2)乙酸与乙醇的反应生成乙酸乙酯和水,发生酯化反应时,酸脱羟基醇脱氢;(3)溴乙烷与氢氧化钠水溶液共热发生取代反应生成乙醇和溴化钠;(4)苯与浓硫酸、浓硝酸的混合酸在加热时发生取代反应生成硝基苯和水。
(1)乙醇和浓硫酸混合物加热到170℃发生消去反应生成乙烯,方程式是CH3CH2OH![]() CH2=CH2↑+H2O;反应类型是消去反应;(2)乙酸与乙醇的反应生成乙酸乙酯和水,反应方程式是CH3COOH+CH3CH2OH
CH2=CH2↑+H2O;反应类型是消去反应;(2)乙酸与乙醇的反应生成乙酸乙酯和水,反应方程式是CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,发生酯化反应时,酸脱羟基醇脱氢,所以水中氧元素的来源是乙酸;(3)溴乙烷与氢氧化钠水溶液共热发生取代反应生成乙醇和溴化钠,反应方程式是CH3CH2Br+NaOH
CH3COOCH2CH3+H2O,发生酯化反应时,酸脱羟基醇脱氢,所以水中氧元素的来源是乙酸;(3)溴乙烷与氢氧化钠水溶液共热发生取代反应生成乙醇和溴化钠,反应方程式是CH3CH2Br+NaOH![]() CH3CH2OH+NaBr,此反应将卤代烃类物质转化为醇类物质;(4)苯与浓硫酸、浓硝酸的混合酸在加热时发生反应生成硝基苯和水,反应方程式是
CH3CH2OH+NaBr,此反应将卤代烃类物质转化为醇类物质;(4)苯与浓硫酸、浓硝酸的混合酸在加热时发生反应生成硝基苯和水,反应方程式是![]() +HNO3
+HNO3![]()
![]() +H2O,反应类型是取代反应。
+H2O,反应类型是取代反应。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B. 标准状况下,38g3H2O2中含有3NA共价键
C. 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D. 0.1molL-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则乙醇燃烧的热化学方程式为__________________________________________________________ 。
(2)由于C3H8(g)![]() C3H6(g)+H2(g) ΔH=+bkJ·mol-1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
C3H6(g)+H2(g) ΔH=+bkJ·mol-1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(3)关于用水制取二次能源氢气,以下研究方向不正确的是(________)
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(4)已知下列两个热化学方程式:
A、2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1
2H2O(l) △H=-571.6kJ·mol-1
B、C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) △H=-2220kJ·mol-1
3CO2(g)+4H2O(l) △H=-2220kJ·mol-1
其中,能表示燃烧热的热化学方程式为__________,其燃烧热△H=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全一直是社会关注的话题。过氧化苯甲酰(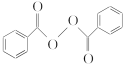 )过去常用作面粉增白剂,但目前已被禁用。合成过氧化苯甲酰的流程图如下:
)过去常用作面粉增白剂,但目前已被禁用。合成过氧化苯甲酰的流程图如下:
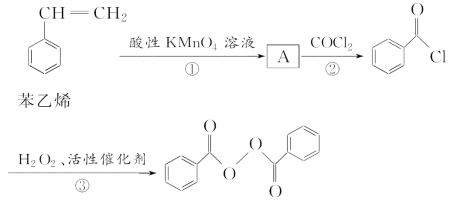
请回答下列问题:
(1)A的结构简式为________________;②的反应类型为________________。
(2)写出反应③的化学方程式:_________________________________________
过氧化苯甲酰在酸性条件下水解的化学方程式为__________________________________。
(3)下列有关苯乙烯的说法正确的是______(填字母)。
A.苯乙烯能使溴水褪色 B.苯乙烯存在一种同分异构体,其一氯代物仅有一种
C.苯乙烯分子中8个碳原子可能共平面 D.苯乙烯、庚烷燃烧耗氧量肯定相等
(4)写出一个符合下列要求的过氧化苯甲酰的同分异构体的结构简式______________。
①分子中不含碳碳双键或三键;
②分子中只含有一种含氧官能团;
③核磁共振氢谱有3组峰,其峰面积之比为1∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.
回答下列问题:
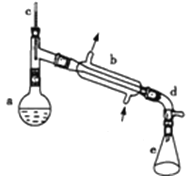
(1)由环己醇制取环己烯的反应类型为_________;
(2)装置b的冷凝水方向是______(填下进上出或上进下出);
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为____.
(5)在分离提纯中,使用到的仪器f名称是_____,分离氯化钙的操作是_____.
(6)合成过程中加入浓硫酸的作用是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是

A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是

A.闭合开关K,电流表指针发生偏转,证明HCl溶液是电解质
B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化
C.闭合开关K,向溶液中加入少量NaOH固体,电流表示数几乎不变
D.选取相同浓度的硫酸替换0.1mol·L-1的HCl溶液,电流表的示数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前20号元素W、X、Y、Z的原子序数依次增大,W、X、Y三种元素所在周期序数之和等于7,这四种元素可组成中学常见的离子化合物ZYWX,其常用于检测溶液中的某种金属阳离子;W、X、Y组成一种共价化合物分子(X![]() W—Y—Y—W
W—Y—Y—W![]() X),该分子中每个原子最外层都达到8电子稳定结构。下列推断正确的是( )
X),该分子中每个原子最外层都达到8电子稳定结构。下列推断正确的是( )
A.W的氢化物的熔点一定比X的低
B.Z2Y是只含一种化学键的离子化合物
C.Y的氧化物对应的水化物一定是强酸
D.简单离子的半径大小:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com