
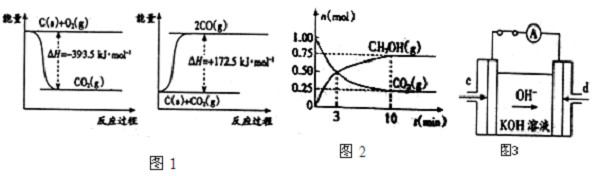
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
| △c |
| △t |
| ||
| 10min |
| KW |
| 5.61×10-11 |
| KW |
| 1.77×10-5 |


科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO 、AlO
、AlO 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
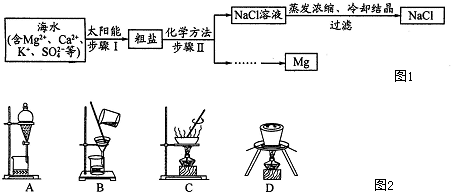
| Bacl2 |
| ① |
| NaOH |
| ② |
| Na2CO3 |
| ③ |
| HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B、二氧化氮经过加压凝成无色液体为物理变化 |
| C、Na2O?SiO2是一种简单的硅酸盐,可溶于水 |
| D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com