
 钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:
钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用.已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3.请回答下列问题:分析 (1)在空气中加热CoCO3可以和氧气反应得到黑色Co3O4,据此书写方程式;
(2)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,据此回答;
(3)依据溶度积常数结合Co2+完全沉淀,即c(Co2+)<10-5 mol•L-1,计算溶液中氢氧根离子浓度,得到溶液PH;
(4)Co(OH)2酸式电离电离出氢离子和[Co(OH)4]2-,结合氢氧化铝的两性来回答;
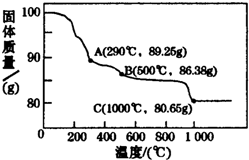
(5)①1000℃时,Co(OH)2在空气中加热得到的固体质量不再发生变化,根据质量变化情况来计算;
②由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),然后计算钴氧化物中n(Co2+):n(Co3+).
解答 解:(1)在空气中加热CoCO3可以和氧气反应得到黑色Co3O4,即6CoCO3+O2=2Co3O4+6CO2,故答案为:6CoCO3+O2=2Co3O4+6CO2;
(2)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,发生反应的离子方程式为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O,故答案为:Co3O4+8H++2Cl-═3Co2++Cl2↑+4H2O;
(3)Co2+完全沉淀,即c(Co2+)<10-5 mol•L-1,Ksp=c(Co2+)c2(OH-),溶液中氢氧根离子浓度=$\sqrt{\frac{1.0×1{0}^{-15}}{1{0}^{-5}}}$=10-5mol/L,所以c(H+)=10-9mol/L,若要使0.1mol•L-1CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为≥9,故答案为:≥9;
(4)Co(OH)2酸式电离电离出氢离子和=[Co(OH)4]2-,电离方程式为:Co(OH)2+2H2O[Co(OH)4]2-+2H+,故答案为:Co(OH)2+2H2O[Co(OH)4]2-+2H+;
(5)①由于Co有+2、+3价,原始为Co(OH)2,相对分子质量为93,得到固体的质量是x,则$\frac{x}{93}$=$\frac{80.65}{100}$,解得x=75,所以得到的固体成分为为CoO,故答案为:CoO.
②由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{4.48L}{22.4L/mol}$=0.4 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×$\frac{4.48L}{22.4L/mol}$)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,则钴氧化物中n(Co2+):n(Co3+)=0.64:0.4=3:2;
故答案为:3:2.
点评 本题考查元素化合价的判断、物质化学式的计算、得失电子守恒规律的应用、对图象的分析处理等,注意利用电子守恒和原子守恒计算,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③④⑦ | B. | 只有⑤⑥⑧⑨⑩ | C. | 只有①③⑤⑦⑨ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
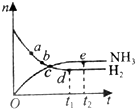
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为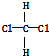 和 和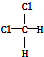 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
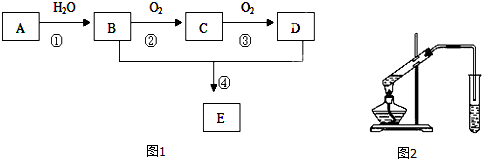
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com