
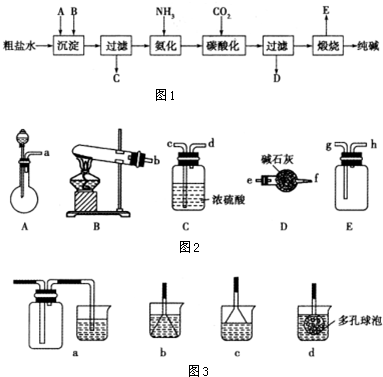
分析 (1)①根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置;若要制取、收集干燥的CO2,应选择A发生装置,用C干燥二氧化碳,用E装置收集气体,按照制取、除杂、收集的顺序连接实验装置;
②NaOH溶于水放出大量的热,且氢氧化钠溶液中含有大量氢氧根离子,能够抑制一水合氨的电离,促进氨气的挥发;
③氨气极易溶于水,应采取防止倒吸的方法吸收;
(2)根据题意A源于石灰窑,说明其是生石灰或熟石灰来分析;除去过量的钙离子应选择碳酸钠;
(3)根据碳酸钠和碳酸氢钠的性质和溶解度解答;
(4)铵盐能与碱在加热条件下反应生成氨气;
(5)碳酸氢钠受热易分解生成碳酸钠和水、二氧化碳,依据碳酸氢钠的不稳定性设计实验.
解答 解:(1)①实验室制取氨气反应物状态氯化铵、氢氧化钙都是固体,反应条件加热,采用固体、固体加热型装置,所以应选B为反应装置;生成物中含有水,氨气属于碱性气体,所以应选择碱性物质吸收水蒸气,故选D;氨气极易溶于水,且氨气的密度小于空气的密度,所以应采用向下排空气法收集,故选E;
制取、收集干燥的CO2,应选择A发生装置,用C干燥二氧化碳,用E装置收集气体,所以连接顺序为:acdg;
故答案为:BDE;acdg;
②NaOH溶于水放出大量的热,可促进氨气的挥发,另外氨水溶液呈碱性,为弱电解质,加入氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;
故答案为:NaOH溶于水放出大量的热,可促进氨气的挥发,另外氨水溶液呈碱性,为弱电解质,加入氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;
③氨气极易溶于水,所以尾气处理应采用防止倒吸装置,用水吸收即可,应选择c,故选:c;
(2)粗盐水中含有Mg2+、Ca2+,用Ca(OH)2或CaO将Mg2+转化为Mg(OH)2,再用Na2CO3将Ca2+转化为CaCO3沉淀,
故答案为:Ca(OH)2 或者CaO;Na2CO3;
(3)由于溶液中存在氨气,氯化钠,当通入二氧化碳后,碳酸化后发生反应的化学方程式是NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓,有晶体析出;相同温度下,碳酸氢钠的溶解性小于碳酸钠,所以固体先以碳酸氢钠形式析出;
故答案为:有晶体析出;碳酸钠溶解度大于碳酸氢钠;
(4)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(5)碳酸氢钠不稳定,受热易分解生成碳酸钠和水、二氧化碳,称取一定质量的固体样品,加热到恒重后冷却,称量剩余固体的质量,计算出碳酸氢钠的质量分数;
答:称取一定质量的固体样品,加热到恒重后冷却,称量剩余固体的质量,计算出碳酸氢钠的质量分数.
点评 本题为工艺流程题,考查了物质的制备、提纯、实验的操作等,题目难度中等,熟悉反应原理和各种物质的性质是解题关键,侧重考查学生分析问题解决问题能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
 用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反
用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反| A. | Cu电极与电源正极相连 | |
| B. | 聚合氯化铝化学式中x=4 | |
| C. | 电解时阴极的电极反应式为:2H++2e?═H2↑ | |
| D. | 将电源换成导线连接两电极,则不能形成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y形成的简单离子,其半径大小关系为W>X>Y | |
| B. | M、W元素形成的简单氢化物的稳定性:W>M | |
| C. | X是同周期中金属性最强的元素 | |
| D. | Z的最高价氧化物对应的水化物的浓溶液能与Y的单质在常温下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
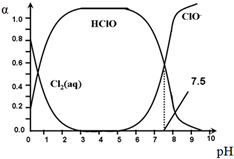 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 | |
| B. | pH=7.5时,用氯处理饮用水体系中,c(Cl-)+c(HClO)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是258 | B. | 质量数是101 | C. | 中子数是157 | D. | 电子数是359 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com