
分析 (1)△G=△H-T△S=0,说明此反应达到平衡状态,利用三段法计算平衡反应速率以及平衡浓度;
(2)容积不变通入惰性气体,因为浓度不变,平衡不移动.
解答 解:(1)△G=△H-T△S=0,说明反应达到平衡状态;
设充入NH3为xmol,
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
加入量 x 2x 0 0
反应量 0.2x 0.25x 0.2x 0.3x
平衡量 2 2x-0.25x 0.2x 0.3x
2min后达到平衡,NH3为2mol,NH3的转化率为20%,
x-0.2x=2,解得x=2.5,用NO的浓度变化表示该反应的平均反应速率为$\frac{\frac{0.2×2.5mol}{5L}}{2min}$=0.25mol•L-1•min-1,
O2的平衡浓度为$\frac{2×2.5mol-0.25×2.5mol}{5L}$=0.875mol•L-1,故答案为:平衡;0.25mol•L-1•min-1;0.875mol•L-1 ;
(2)容积不变通入惰性气体,因为浓度不变,平衡不移动,故答案为:不.
点评 本题主要考查的是化学平衡状态的判断.化学反应速率的计算以及平衡是否移动的判断等,三段法为解决此类题目的常用方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH=CH3COO-+H+ | B. | NaOH=Na++OH- | ||
| C. | NH4Cl?NH4++Cl- | D. | NaHCO3=Na++H++CO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓ | |
| B. | NaOH溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | NaHCO3溶液与盐酸的反应:HCO3-+H+=H2O+CO2↑ | |
| D. | KCl溶液与AgNO3溶液的反应:Cl-+Ag+=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
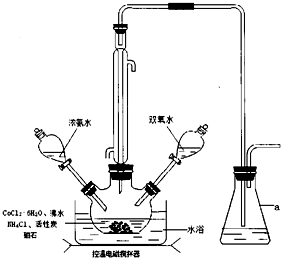
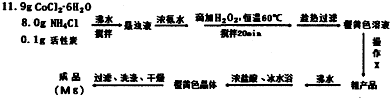
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦ | B. | ①③④⑥⑦ | C. | ①④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com