
| 消耗量 |
| 起始量 |
| ①+②×3 |
| 2 |
| (-2741.8KJ/mol)+(-566KJ/mol)×3 |
| 2 |
| 0.6mol |
| 2.4mol/L |
| c(HCO3-(OH-)) |
| c(CO32-) |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
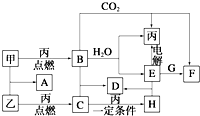 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,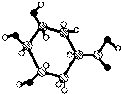 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g | B、3.36g |
| C、5.60g | D、6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、戊烷有2种同分异构体 |
| B、C8H10中只有三种属于芳香烃的同分异构体 |
| C、甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| D、CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
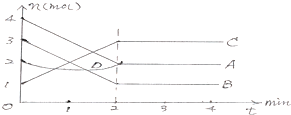
| A、该反应的方程式为:2A+2B?2C+D |
| B、该反应的方程式为:2A+2B=2C 催化剂是D |
| C、该反应是从正反应方向开始的 |
| D、平衡时,V(A)正=V(B)逆=V(C)逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com