
| A. | v(H2)=v(N2)=v(NH3) | B. | 3 v(H2)=v(N2) | C. | 2 v(N2)=v(NH3) | D. | v(NH3)=3/2v(H2) |
分析 合成氨的反应3H2+N2?2NH3中,化学反应速率与化学计量数成正比,据此对各选项进行判断.
解答 解:A.速率之比等于化学计量数之比,所以v(H2):v(N2):v(NH3)=3:1:2,故A错误;
B.速率之比等于化学计量数之比,所以v(H2):v(N2)=3:1,即v(H2)=3v(N2),故B错误;
C.根据反应可知,v(N2):v(NH3)=1:2,则2v(N2)=v(NH3),故C正确;
D.v(H2):v(NH3)=3:2,则v(NH3)=$\frac{2}{3}$v(H2),故D错误;
故选C.
点评 本题考查了化学反应速率的计算,题目难度不大,明确化学反应速率与化学计量数的关系为解答关键,注意掌握 化学反应速率的概念及表达式,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
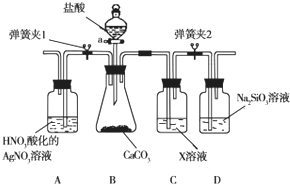 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双缩脲试剂可区分蛋白质溶液和淀粉溶液 | |
| B. | 用水可区分苯,甲苯和溴苯 | |
| C. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| D. | 用溴水可鉴别苯酚溶液,2-己烯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| B. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的结构式:H-O-O-H | B. | C2H4的结构简式:CH2CH2 | ||
| C. | O2-结构示意图: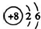 | D. | CCl4的结构式: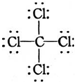 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水的离子方程式:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,若溶液变成蓝色,则氧化性:Cl2>I2 | |
| C. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| D. | 漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中一定含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com