
NA代表阿伏伽德罗常数的值。下列叙述正确的是
A.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA
B.120g NaHSO4固体中含有的离子总数为3NA
C.1 mol Na被氧化生成Na2O2或NaCl,都失去NA个电子
D.1.0 L 1.0 mol·L-1的NaNO3水溶液中含有的氧原子数为3NA
科目:高中化学 来源:2016届辽宁省高三上学期一模化学试卷(解析版) 题型:选择题
下列各组离子能大量共存的是
A.pH<7的溶液中:Na+、S2-、K+、MnO4-
B.pH=7的溶液中:Al3+、Cl-、SO42-、AlO2-
C.pH>7的溶液中:Na+、CO32-、SO32-、K+
D.pH=0的溶液中:Na+、Al3+、Fe2+、ClO-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北大附中河南分校高二上9月考化学试卷(解析版) 题型:选择题
下列变化中生成物的总能量大于反应物的总能量的是
A.H﹣Cl→H+Cl B.H+H→H﹣H
C.Zn+H2SO4=ZnSO4+H2↑ D.HCl+NaOH=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:实验题
(8分)某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:


反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期一模化学试卷(解析版) 题型:选择题
可以大量共存的离子组是
A.Na+、Fe2+、NO3-、Cl- B.K+、HCO3-、SO42-、OH-
C.ClO-、Cl-、Na+、H+ D.Ba2+、K+、SO42-、H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省佛山市高三上学期第一次月考化学试卷(解析版) 题型:选择题
氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
A.LiH的水溶液显中性 B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂 D.LiH中氢离子比锂离子的半径大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高一入学化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH- = SO42-+H2O
C.过氧化钠与水反应:2O22-+2H2O = 4OH-+O2↑
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2 ===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届贵州省贵阳市高三8月摸底考试化学试卷(解析版) 题型:选择题
随着公路上汽车流量的迅速增长,交通事故频繁发生。汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应:
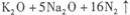 。下列判断正确的是
。下列判断正确的是
A.N2既是氧化剂又是还原剂
B.NaN3中N元素被还原
C.每生成16molN2转移30mole-
D.还原产物与氧化产物质量之比为l:15
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第一次模拟化学试卷(解析版) 题型:填空题
(15分)化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为_______________。
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为 ,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 。
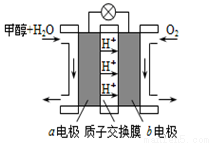
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=(溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com