
【题目】依据元素周期表及元素周期律,下列推断正确的是
A. 碱性:Ca(OH)2 >Mg(OH)2 B. 酸性:H2SO3 > H2CO3
C. 热稳定性:NH3 < PH3 D. 还原性:S2- < F-
【答案】A
【解析】A项,金属性:Ca![]() Mg,碱性:Ca(OH)2
Mg,碱性:Ca(OH)2![]() Mg(OH)2;B项,H2SO3不是硫的最高价氧化物对应的水化物;C项,非金属性:N
Mg(OH)2;B项,H2SO3不是硫的最高价氧化物对应的水化物;C项,非金属性:N![]() P,热稳定性:NH3
P,热稳定性:NH3![]() PH3;D项,非金属性F
PH3;D项,非金属性F![]() S,还原性:S2-
S,还原性:S2-![]() F-。
F-。
A项,Ca和Mg都是第IIA族元素,金属性:Ca![]() Mg,碱性:Ca(OH)2
Mg,碱性:Ca(OH)2![]() Mg(OH)2,A项正确;B项,非金属性S
Mg(OH)2,A项正确;B项,非金属性S![]() C,但H2SO3不是硫的最高价氧化物对应的水化物,不能用元素周期律判断,B项错误;C项,N和P都是第VA族元素,非金属性:N
C,但H2SO3不是硫的最高价氧化物对应的水化物,不能用元素周期律判断,B项错误;C项,N和P都是第VA族元素,非金属性:N![]() P,热稳定性:NH3
P,热稳定性:NH3![]() PH3,C项错误;D项,O和S都是第VIA族元素,非金属性O
PH3,C项错误;D项,O和S都是第VIA族元素,非金属性O![]() S,O和F都是第二周期元素,非金属性F
S,O和F都是第二周期元素,非金属性F![]() O,非金属性F
O,非金属性F![]() S,还原性:S2-
S,还原性:S2-![]() F-,D项错误;答案选A。
F-,D项错误;答案选A。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
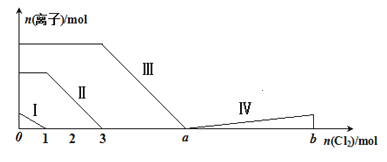
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
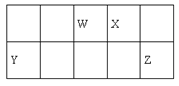
A. 氢化物热稳定性:W<X
B. 最高价氧化物对应水化物的酸性:W<Y
C. Z、W的氢化物的水溶液都呈酸性
D. 简单离子的半径:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0

①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为生锈了的家用铁锅,下列有关解释事实的方程式不正确的是

A. 铁锅生锈过程中有原电池反应,负极反应式是:Fe—2e—= Fe2+
B. 铁锅生锈过程中有 Fe(OH)3生成:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. 摄入体内的铁锈会在胃内产生不利于健康的Fe3+:Fe2O3 + 6H+=2Fe3++3H2O
D. 用醋可除去铁锈:6CH3COOH + Fe2O3 =6CH3COO—+ 2Fe3+ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是
A.化学不再是纯实验科学B.化学不再需要实验
C.化学不做实验,就什么都不知道D.未来化学的方向还是经验化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com