
”¾ĢāÄæ”æ¾ŪŗĻĮņĖįĢś”¢Ć÷·ÆæÉÓĆ×÷¾»Ė®¼Į”£Ä³æĪĢā×éÄāŅŌ·ĻĘśµÄĀĮĢśŗĻ½šĪŖŌĮĻÖʱø¾ŪŗĻĮņĖįĢśŗĶĆ÷·Æ£¬Éč¼Ę»Æ¹¤Į÷³ĢČēĻĀ£ŗ
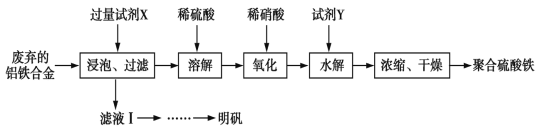
ŅŃÖŖ£ŗ¾ŪŗĻĮņĖįĢśÄÜČÜÓŚĖ®£¬Ī¢ČÜÓŚŅŅ“¼£¬Ęä»ÆѧŹ½æɱķŹ¾ĪŖ[Fe2(OH)x(SO4)y]n”£
(1)ŌŚ¾ŪŗĻĮņĖįĢśÖŠ£¬x”¢yÖ®¼äµÄ¹ŲĻµŹĒ_______________”£ŹŌ¼ĮXÖŠČÜÖŹµÄ»ÆѧŹ½ĪŖ______”£
(2)Š“³öÉĻŹöĮ÷³ĢĶ¼ÖŠµÄ”°Ńõ»Æ”±µÄĄė×Ó·½³ĢŹ½£ŗ______________øĆÉč¼Ę“ęŌŚČ±ĻŻ£¬ĒėĢį³öøĽųŅā¼ū£»________
(3)¼ÓČėŹŌ¼ĮYµÄÄæµÄŹĒĪŖĮĖµ÷½ŚČÜŅŗµÄpH£¬ČōYĪŖŃõ»ÆĪļ£¬Š“³öµ÷½ŚpHµÄĄė×Ó·½³ĢŹ½£ŗ_____
(4)ŅŃÖŖ³£ĪĀĻĀFe(OH)3ŗĶMg(OH)2µÄKsp·Ö±šĪŖ8.0”Į10-38”¢1.0”Į10-11£¬ĻņÅØ¶Č¾łĪŖ0.1mol/LµÄFeCl3”¢MgCl2 µÄ»ģŗĻČÜŅŗÖŠ¼ÓČė¼īŅŗ£¬ŅŖŹ¹Fe3+ øÕŗĆĶźČ«³ĮµķµÄpHĪŖ____£¬¶ųMg2+øÕŗĆæŖŹ¼ŅŖ³ĮµķµÄpHĪŖ__________”££ØŅŃÖŖlg 2=0.3£©
”¾“š°ø”æx+2y=6 KOH 3Fe2+ +4H+ + NO3”Ŗ == 3Fe3+ + NO ”ü +2H2O ½«Ļ”ĻõĖįøÄĪŖĖ«ŃõĖ®»ņĶØČėŃõĘų Fe2O3+6H+£½2Fe3++3H2O 3.3 9
”¾½āĪö”æ
ÓÉĮ÷³ĢæÉÖŖ£¬·ĻĘśµÄĀĮĢśŗĻ½š¼ÓČėĒāŃõ»Æ¼ŲČÜŅŗ½žÅŻ£¬ĀĮ·“Ó¦µĆµ½Ę«ĀĮĖį¼ŲČÜŅŗ£¬¹żĀĖŗóĀĖŅŗ¾Ņ»ĻµĮŠ²Ł×÷·“Ӧɜ³ÉĮņĖįĀĮ¼Ų£¬ĀĖŌüÖŠ¼ÓČėĻ”ĮņĖįŗĶĢś£¬·“Ӧɜ³ÉĮņĖįŃĒĢś£¬¼ÓČėĻ”ĻõĖįŃõ»ÆĪŖĮņĖįĢś£¬¼ÓČėŹŌ¼ĮYµ÷½ŚČÜŅŗµÄpHÖµ£¬µ«²»ÄÜŅżČėŠĀµÄŌÓÖŹ£¬¼ÓČėŃõ»ÆĢśŗĶĖį·“Ó¦Ą“µ÷½ŚČÜŅŗµÄpHÖµ£¬ĖįŠŌŌ½Ē棬¶ŌĢśĄė×ÓĖ®½ā³Ģ¶ČŅÖÖĘŌ½“ó£¬Éś³ÉĒāŃõ»ÆĢśŌ½ÉŁ£¬µĆµ½ČÜŅŗĶعżÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬æÉŅŌµĆµ½¾ŪŗĻĮņĖįĢś£»
(1) øł¾Ż»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖĮć·ÖĪö¼ĘĖć£»øł¾ŻĀĮÄÜÓėĒæ¼ī·“Ó¦£¬Ģś²»ÓėĒæ¼ī·“Ó¦·ÖĪö¼ÓČėµÄŹŌ¼ĮX£»
(2) Į÷³ĢĶ¼ÖŠµÄ”°Ńõ»Æ”±µÄ¹ż³ĢŹĒĻõĖį½«Fe2+Ńõ»ÆĪŖFe3+µÄ¹ż³Ģ£¬¾Ż“ĖŹéŠ“Ąė×Ó·½³ĢŹ½£»“ÓÄܹ»ŅżČėŠĀŌÓÖŹµÄ½Ē¶Č·ÖĪö“ęŌŚµÄȱĻŻ£»
(3)¼ÓČėŃõ»ÆĢś£¬ŗĶĖį·“Ó¦µ÷½ŚČÜŅŗµÄpH£¬²»ŅżČėŠĀµÄŌÓÖŹ£¬ÓÉ“ĖŹéŠ“Ąė×Ó·½³ĢŹ½£»
(4)øł¾ŻKsp[Fe(OH)3]=c(Fe3+)c3(OH-)ŗĶKsp[Mg(OH)2]=c(Mg2+)c2(OH-)¼ĘĖć³öc(OH-)½ųŅ»²½¼ĘĖćpH”£
(1) øł¾Ż»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖĮćæÉÖŖ(+3)”Į2+(-1)”Įx+(-2)”Įy=0£¬Ņņ“ĖæɵĆx”¢yÖ®¼äµÄ¹ŲĻµĪŖx+2y=6£»ĀĮÄÜÓėĒæ¼ī·“Ó¦£¬Ģś²»ÓėĒæ¼ī·“Ó¦£¬ŌŁ½įŗĻ²»ŅżČėŠĀŌÓÖŹµÄŌŌņ£¬æÉÖŖ¼ÓČėµÄŹŌ¼ĮXĪŖKOH£»
(2) Į÷³ĢĶ¼ÖŠµÄ”°Ńõ»Æ”±µÄ¹ż³ĢŹĒĻõĖį½«Fe2+Ńõ»ÆĪŖFe3+µÄ¹ż³Ģ£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗ3Fe2+ +4H+ + NO3- = 3Fe3+ + NO ”ü +2H2O£»Į÷³ĢÖŠŃõ»Æ¹ż³ĢÖŠ¼ÓČėĻ”ĻõĖį£¬»įŅżČėŠĀµÄŌÓÖŹ£¬æɽ«Ļ”ĻõĖįøÄĪŖĖ«ŃõĖ®»ņĶØČėŃõĘų£»
(3) ¼ÓČėŃõ»ÆĢś£¬ŗĶĖį·“Ó¦µ÷½ŚČÜŅŗµÄpH£¬²»ŅżČėŠĀµÄŌÓÖŹ£¬Ņņ“ĖĄė×Ó·½³ĢŹ½ĪŖ£ŗFe2O3+6H+£½2Fe3++3H2O£»
(4) ŅņKsp[Fe(OH)3]=c(Fe3+)c3(OH-)£¬ÄĒĆ“c(OH-)=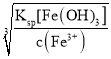 =
=![]() =2”Į10-13”Į
=2”Į10-13”Į![]() mol/L£¬ŅņKsp[Mg(OH)2]=c(Mg2+)c2(OH-)£¬ÄĒĆ“c(OH-)=
mol/L£¬ŅņKsp[Mg(OH)2]=c(Mg2+)c2(OH-)£¬ÄĒĆ“c(OH-)=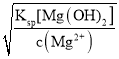 =
=![]() =1.0”Į10-5mol/L£¬“ĖŹ±¼“ŅŖŹ¹Fe3+ øÕŗĆĶźČ«³Įµķ£¬c(OH-)=2”Į10-13”Į
=1.0”Į10-5mol/L£¬“ĖŹ±¼“ŅŖŹ¹Fe3+ øÕŗĆĶźČ«³Įµķ£¬c(OH-)=2”Į10-13”Į![]() mol/L£¬ÄĒĆ“c(H+)=
mol/L£¬ÄĒĆ“c(H+)=![]() £¬“ĖŹ±ČÜŅŗµÄpH=3.3£»Mg2+øÕŗĆæŖŹ¼ŅŖ³Įµķ£¬c(OH-)=1.0”Į10-5mol/L£¬ÄĒĆ“c(H+)=
£¬“ĖŹ±ČÜŅŗµÄpH=3.3£»Mg2+øÕŗĆæŖŹ¼ŅŖ³Įµķ£¬c(OH-)=1.0”Į10-5mol/L£¬ÄĒĆ“c(H+)=![]() =10-9mol/L£¬“ĖŹ±pH=9”£
=10-9mol/L£¬“ĖŹ±pH=9”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜÕżČ·±ķŹ¾ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ
A. Įņ»ÆŃĒĢśČÜÓŚĻ”ĻõĖįÖŠ£ŗFeS+2H+=Fe2++H2S![]()
B. NH4HCO3ČÜÓŚ¹żĮæµÄNaOHČÜŅŗÖŠ£ŗHCO3-+OH-=CO32-+H2O
C. ÉŁĮæSO2ĶØČė±½·ÓÄĘČÜŅŗÖŠ£ŗC6H5O-+SO2+H2O=C6H5OH+HSO3-
D. “óĄķŹÆČÜÓŚ“×ĖįÖŠ£ŗCaCO3+2CH3COOH=Ca2++2CH3COO-+CO2![]() +H2O
+H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ5©¶ž¼×Ńõ»ł±½·ÓŹĒÖŲŅŖµÄÓŠ»śŗĻ³ÉÖŠ¼äĢ壬æÉÓĆÓŚĢģČ»ĪļÖŹ°×ÄūĆŹĖŲµÄŗĻ³É£¬Ņ»ÖÖŅŌ¼ä±½Čż·ÓĪŖŌĮĻµÄŗĻ³É·“Ó¦ČēĻĀ£ŗ

¼×“¼”¢ŅŅĆŃŗĶ3£¬5©¶ž¼×Ńõ»ł±½·ÓµÄ²æ·ÖĪļĄķŠŌÖŹ¼ūĻĀ±ķ£ŗ

£Ø1£©·“Ó¦½įŹųŗó£¬ĻČ·ÖĄė³ö¼×“¼£¬ŌŁ¼ÓČėŅŅĆŃ½ųŠŠŻĶČ”£¬¢Ł·ÖĄė³ö¼×“¼µÄ²Ł×÷ŹĒµÄ______£»¢ŚŻĶČ”ÓƵ½µÄ·ÖŅŗĀ©¶·Ź¹ÓĆĒ°Šč__________________²¢Ļ“¾»£¬·ÖŅŗŹ±ÓŠ»ś²ćŌŚ·ÖŅŗĀ©¶·µÄ________Ģī£Ø”°ÉĻ”±»ņ”°ĻĀ”±£©²ć£»
£Ø2£©·ÖĄėµĆµ½µÄÓŠ»ś²ćŅĄ“ĪÓƱ„ŗĶNaHCO3ČÜŅŗ”¢±„ŗĶŹ³ŃĪĖ®”¢ÉŁĮæÕōĮóĖ®½ųŠŠĻ“µÓ£®ÓƱ„ŗĶNaHCO3ČÜŅŗĻ“µÓµÄÄæµÄŹĒ__£¬ÓƱ„ŗĶŹ³ŃĪĖ®Ļ“µÓµÄÄæµÄŹĒ______£»
£Ø3£©Ļ“µÓĶź³Éŗó£¬ĶعżŅŌĻĀ²Ł×÷·ÖĄė”¢Ģį“æ²śĪļ£¬ÕżČ·µÄ²Ł×÷Ė³ŠņŹĒ__£ØĢī×ÖÄø£©£»
a£®ÕōĮó³żČ„ŅŅĆŃ b£®ÖŲ½į¾§ c£®¹żĀĖ³żČ„øÉŌļ¼Į d£®¼ÓČėĪŽĖ®CaCl2øÉŌļ
£Ø4£©¹ĢŅŗ·ÖĄė³£²ÉÓĆ¼õŃ¹¹żĀĖ£®ĪŖĮĖ·ĄÖ¹µ¹Īü£¬¼õŃ¹¹żĀĖĶź³ÉŗóÓ¦ĻČ________________£¬ŌŁ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĮņĖįŃĒĢśČÜŅŗÖŠ¼ÓČė¹żŃõ»ÆÄĘŹ±·¢Éś·“Ó¦£ŗ4Fe2£«£«4Na2O2£«6H2O=4Fe(OH)3”ż£«O2”ü£«8Na£«£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.øĆ·“Ó¦ÖŠFe2£«ŹĒ»¹Ō¼Į£¬O2ŹĒ»¹Ō²śĪļ
B.4 mol Na2O2ŌŚ·“Ó¦ÖŠ¹²µĆµ½8NAøöµē×Ó
C.ĆæÉś³É0.2 mol O2£¬Ōņ±»Fe2£«»¹ŌµÄŃõ»Æ¼ĮĪŖ0.4 mol
D.·“Ó¦¹ż³ĢÖŠæÉŅŌ擵½°×É«³Įµķ×Ŗ»ÆĪŖ»ŅĀĢÉ«ŌŁ×Ŗ»ÆĪŖŗģŗÖÉ«³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹āĘų(COCl2)µÄ·Ö½ā·“Ó¦ĪŖ£ŗCOCl2(g)![]() Cl2(g)£«CO(g)¦¤H£½£«108kJ”¤mol-1”£·“Ó¦ĢåĻµ“ļµ½Ę½ŗāŗó£¬ø÷ĪļÖŹµÄÅضČŌŚ²»Ķ¬Ģõ¼žĻĀµÄ±ä»ÆדæöČēĶ¼ĖłŹ¾(µŚ10minµ½14minµÄCOCl2ÅØ¶Č±ä»ÆĒśĻßĪ“Ź¾³ö)£ŗ
Cl2(g)£«CO(g)¦¤H£½£«108kJ”¤mol-1”£·“Ó¦ĢåĻµ“ļµ½Ę½ŗāŗó£¬ø÷ĪļÖŹµÄÅضČŌŚ²»Ķ¬Ģõ¼žĻĀµÄ±ä»ÆדæöČēĶ¼ĖłŹ¾(µŚ10minµ½14minµÄCOCl2ÅØ¶Č±ä»ÆĒśĻßĪ“Ź¾³ö)£ŗ

£Ø1£©¼ĘĖć·“Ó¦ŌŚµŚ8minŹ±µÄĘ½ŗā³£ŹżK=__£»
£Ø2£©±Č½ĻµŚ2min·“Ó¦ĪĀ¶ČT(2)ÓėµŚ8min·“Ó¦ĪĀ¶ČT(8)µÄøßµĶ£ŗT(2)__T(8)(Ģī”°<”±”¢”°>”±»ņ”°£½”±)£»
£Ø3£©Čō12minŹ±·“Ó¦ÓŚĪĀ¶ČT(8)ĻĀÖŲŠĀ“ļµ½Ę½ŗā£¬Ōņ“ĖŹ±c(COCl2)=__mol”¤L-1£»
£Ø4£©±Č½Ļ²śĪļCOŌŚ2”«3min”¢5”«6minŗĶ12”«13minŹ±Ę½¾ł·“Ó¦ĖŁĀŹ[Ę½¾ł·“Ó¦ĖŁĀŹ·Ö±šŅŌv(2”«3)”¢v(5”«6)”¢v(12”«13)±ķŹ¾]µÄ“óŠ”__£»
£Ø5£©±Č½Ļ·“Ó¦ĪļCOCl2ŌŚ5”«6minŗĶ15”«16minŹ±Ę½¾ł·“Ó¦ĖŁĀŹµÄ“󊔣ŗv(5”«6)__v(15”«16)(Ģī”°<”±”¢”°>”±»ņ”°£½”±)£¬ŌŅņŹĒ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®µÄµēĄė¹ż³ĢĪŖH2O![]() H++OH£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀĘäĄė×Ó»żĪŖKw(25”ę)=1.0”Į1014£¬Kw(35”ę)=2.1”Į1014£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ
H++OH£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀĘäĄė×Ó»żĪŖKw(25”ę)=1.0”Į1014£¬Kw(35”ę)=2.1”Į1014£¬ŌņĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A.c(H+)Ėę×ÅĪĀ¶ČµÄÉżø߶ų½µµĶ
B.ŌŚ35 ”ę µÄ“æĖ®ÖŠŹ±£¬c(H+)£¾c(OH)
C.Ė®µÄµēĄė³£ŹżKw(25”ę)£¾Kw(35”ę)
D.Ė®µÄµēĄėŹĒŅ»øöĪüČČ¹ż³Ģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ūĻ©ŹĒ½ö“ĪÓŚŅŅĻ©µÄÓŠ»ś»Æ¹¤ŌĮĻ£¬æÉÓɱūĶéĶŃĒāŃõ»ÆÖĘČ””£±ūĶéĶŃĒāŃõ»Æ¹¤ŅÕ°üŗ¬µÄ·“Ó¦ÓŠ£ŗ
Ö÷·“Ó¦£ŗ¢ŁC3H8£Øg£©![]() C3H6£Øg£©£«H2£Øg£© ”÷H1£½£«124.27 kJ”¤mol£1£ØĶŃĒā·“Ó¦£©
C3H6£Øg£©£«H2£Øg£© ”÷H1£½£«124.27 kJ”¤mol£1£ØĶŃĒā·“Ó¦£©
¢ŚH2£Øg£©£«![]() O2£Øg£©£½H2O£Øg£© ”÷H2£½£241.82 kJ”¤mol£1£ØÉÕĒā·“Ó¦£©
O2£Øg£©£½H2O£Øg£© ”÷H2£½£241.82 kJ”¤mol£1£ØÉÕĒā·“Ó¦£©
ø±·“Ó¦£ŗ¢ŪC3H8£Øg£©![]() CH4£Øg£©£«C2H4£Øg£© ”÷H3£½£«81.30 kJ”¤mol£1
CH4£Øg£©£«C2H4£Øg£© ”÷H3£½£«81.30 kJ”¤mol£1
¢ÜC2H4£Øg£©£«H2£Øg£©![]() C2H6£Øg£© ”÷H4£½£136.94 kJ”¤mol£1
C2H6£Øg£© ”÷H4£½£136.94 kJ”¤mol£1
¢ŻC3H8£Øg£©£«H2£Øg£©![]() CH4£Øg£©£«C2H6£Øg£© ”÷H5
CH4£Øg£©£«C2H6£Øg£© ”÷H5
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©”÷H5£½____kJ”¤mol£1”£
£Ø2£©Ķ¼1ŹĒÖʱø¹¤ŅÕÖŠŅ»Š©·“Ó¦Ę½ŗā³£ŹżµÄ¶ŌŹżÖµÓėĪĀ¶ČµÄ¹ŲĻµĶ¼£¬ÓūĢįøß±ūĻ©µÄ²śĀŹ£¬ÄÜ·ń¾”æÉÄܵÄĢįøß·“Ó¦ĪĀ¶Č?_________£¬ĘäŌŅņŹĒ__________________”£³żĪĀ¶ČĶā£¬ĻĀĮŠ»¹æÉĢįøß±ūĻ©²śĀŹµÄ“ėŹ©ÓŠ_________£ØĢīŠņŗÅ£©

A ½µµĶŃ¹Ēæ B Ōö“óŃ¹Ēæ
C ²ÉÓĆŃ”ŌńŠŌÓÅĮ¼µÄ“߻ƼĮ D Ń”ŌńŠŌµÄŃõ»ÆĻū³ż²æ·ÖĒāĘų
£Ø3£©Źµ¼ŹĶŃĒā¹¤ŅÕÖŠ³£³£ĶØČėĖ®ÕōĘū£¬ŅŌøıä±ūĶéµÄĘ½ŗā×Ŗ»ÆĀŹ”£Ķ¼2ĪŖ³£Ń¹”¢600”«1000KŹ±£¬²»Ķ¬Ė®Ģž±ČMĻĀ±ūĶéĶŃĒā·“Ó¦µÄĘ½ŗā×Ŗ»ÆĀŹ±ä»ÆĶ¼”£ÓÉĶ¼æÉÖŖ£¬³£Ń¹”¢ĪĀ¶Čŗć¶ØŹ±Ė®Ģž±Č¶ŌĘ½ŗā×Ŗ»ÆĀŹµÄÓ°Ļģ¹ęĀÉĪŖ____________”£ÉčijĪĀ¶Č”¢1 atm£Ø¼ĒĪŖp0£©ĻĀ±ūĶéµÄĶŃĒā×Ŗ»ÆĀŹĪŖy£¬¼ÓČė·“Ó¦ĢåĻµµÄĖ®ÕōĘūÓėŌĮĻ±ūĶéµÄĪļÖŹµÄĮæÖ®±ČĪŖM£¬ŌņĶŃĒā·“Ó¦µÄĘ½ŗā³£ŹżKp£½____£ØKpĪŖŅŌ·ÖŃ¹±ķŹ¾µÄĘ½ŗā³£Źż£¬Š“³ö±ķ“ļŹ½¼“æÉ£©”£
£Ø4£©µ±·“Ó¦ĪĀ¶ČĪŖ923KŹ±£¬¼ĘĖćæÉÖŖĶŃĒā·“Ó¦µÄ·“Ó¦ČČĪŖ£«115.66 kJ”¤mol£1£¬ÉÕĒā·“Ó¦µÄ·“Ó¦ČČĪŖ£237.75 kJ”¤mol£1£¬ĪŖ±£Ö¤ÉÕĒāĖł·ÅČČĮæĶźČ«Āś×ćĶŃĒāĪüČČÖ®ÓĆ£Ø¼ŁÉčĶŃĒāĀŹĪŖ100%£©£¬ŌņÉÕĒāĀŹÓ¦“óÓŚ_____£»ÓÉ“Ėæɼū£¬ÉÕĒā¹ż³Ģ²»½öæÉŅŌĢįøß±ūĶéĶŃĒāµÄ×Ŗ»ÆĀŹ£¬»¹æÉŅŌ_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀČ°±ŹĒĀČĘųÓöµ½°±Ęų·“Ӧɜ³ÉµÄŅ»Ąą»ÆŗĻĪļ£¬ŹĒ³£ÓƵÄŅūÓĆĖ®¶ž¼¶Ļū¶¾¼Į£¬Ö÷ŅŖ°üĄØŅ»ĀČ°·”¢¶žĀČ°·ŗĶČżĀČ°·(NH2Cl”¢NHCl2ŗĶNCl3)£¬ø±²śĪļÉŁÓŚĘäĖüĖ®Ļū¶¾¼Į”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¢ŁŅ»ĀČ°·(NH2Cl)µÄµē×ÓŹ½ĪŖ ________________ ”£
¢Ś¹¤ŅµÉĻæÉĄūÓĆ·“Ó¦Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)ÖʱøŅ»ĀČ°·£¬ŅŃÖŖ²æ·Ö»Æѧ¼üµÄ¼üÄÜČēĻĀ±ķĖłŹ¾£Ø¼ŁÉč²»Ķ¬ĪļÖŹÖŠĶ¬ÖÖ»Æѧ¼üµÄ¼üÄÜĻąĶ¬£©£¬ŌņøĆ·“Ó¦µÄ”÷H=________”£
»Æѧ¼ü | N-H | Cl-Cl | N-Cl | H-Cl |
¼üÄÜ(kJ/mol) | 391 | 243 | 191 | 431 |
¢ŪŅ»ĀČ°·ŹĒÖŲŅŖµÄĖ®Ļū¶¾¼Į£¬ĘäŌŅņŹĒÓÉÓŚŅ»ĀČ°·ŌŚÖŠŠŌ”¢ĖįŠŌ»·¾³ÖŠ»į·¢ÉśĖ®½ā£¬Éś³É¾ßÓŠĒæĮŅɱ¾śĻū¶¾×÷ÓƵÄĪļÖŹ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________________________”£
(2)ÓĆCl2ŗĶNH3·“Ó¦Öʱø¶žĀČ°·µÄ·½³ĢŹ½ĪŖ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)£¬ĻņČŻ»ż¾łĪŖ1 LµÄ¼×”¢ŅŅĮ½øöŗćĪĀ£Ø·“Ó¦ĪĀ¶Č·Ö±šĪŖ400”ę”¢T”ę)ČŻĘ÷ÖŠ·Ö±š¼ÓČė2 mol Cl2ŗĶ2 mol NH3£¬²āµĆø÷ČŻĘ÷ÖŠn(Cl2)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾£ŗ
NHCl2(l)+2HCl(g)£¬ĻņČŻ»ż¾łĪŖ1 LµÄ¼×”¢ŅŅĮ½øöŗćĪĀ£Ø·“Ó¦ĪĀ¶Č·Ö±šĪŖ400”ę”¢T”ę)ČŻĘ÷ÖŠ·Ö±š¼ÓČė2 mol Cl2ŗĶ2 mol NH3£¬²āµĆø÷ČŻĘ÷ÖŠn(Cl2)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾£ŗ
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(¼×ČŻĘ÷)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (ŅŅČŻĘ÷£©/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
¢Ł¼×ČŻĘ÷ÖŠ£¬0”«40 minÄŚÓĆNH3µÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(NH3)=___________”£
¢ŚøĆ·“Ó¦µÄ”÷H________0(Ģī”°>”±»ņ”°<”±) ”£
¢Ū¶ŌøĆ·“Ó¦£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ______________(ĢīŃ”Ļī×ÖÄø£©”£
A£®ČōČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»±ä£¬Ōņ±ķĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬
B£®ČōČŻĘ÷ÄŚCl2ŗĶNH3ĪļÖŹµÄĮæÖ®±Č²»±ä£¬Ōņ±ķĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬
C£®·“Ó¦“ļµ½Ę½ŗāŗó£¬ĘäĖūĢõ¼ž²»±ä£¬ŌŚŌČŻĘ÷ÖŠ³äČėŅ»¶ØĮæŗ¤Ęų£¬Cl2µÄ×Ŗ»ÆĀŹŌö“ó
D£®·“Ó¦“ļµ½Ę½ŗāŗó£¬ĘäĖūĢõ¼ž²»±ä£¬¼ÓČėŅ»¶ØĮæµÄNHCl2£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅʶÆ
(3)ŌŚŗćĪĀĢõ¼žĻĀ£¬2molCl2ŗĶ1molNH3·¢Éś·“Ó¦2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)£¬²āµĆĘ½ŗāŹ±Cl2ŗĶHClµÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
NHCl2(l)+2HCl(g)£¬²āµĆĘ½ŗāŹ±Cl2ŗĶHClµÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ

¢ŁA”¢B”¢CČżµćÖŠCl2×Ŗ»ÆĀŹ×īøߵďĒ______µć(Ģī”°A”±”°B”±»ņ”°C”±)”£(ĢįŹ¾£ŗCµćŹ±HClŗĶCl2µÄÅضČĻąµČ)
¢Ś¼ĘĖćCµćŹ±øĆ·“Ó¦µÄŃ¹ĒæĘ½ŗā³£ŹżKp(C)=_________(KpŹĒĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹=×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
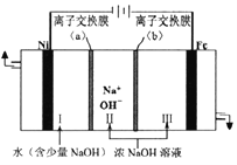
”¾ĢāÄæ”æŅŌ·ĻÄų(ŗ¬NiO£¬ŌÓÖŹĪŖÉŁĮæFe2O3)Éś²śNi2O3µÄŅ»ÖÖ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
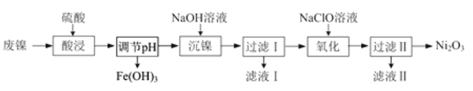
(1)”°Ėį½ž”±Ź±ĪŖĮĖĢįøßĖį½žµÄĖŁĀŹ(½žČ”ĀŹ)£¬æɲÉČ”µÄ“ėŹ©ÓŠ_____________(ČĪŠ“³öŅ»Ģõ)”£
(2)”°Ėį½ž”±Ź±Fe2O3·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ____________________________________”£
(3)”°µ÷½ŚpH”±Ź¹ČÜŅŗÖŠµÄFe3£«³ĮµķĶźČ«(Ąė×ÓÅØ¶Č”Ü10£5mol”¤L£1Ź±£¬Ąė×Ó³ĮµķĶźČ«)£¬ŌņŠčĪ¬³Öc(OH£)²»µĶÓŚ__________ [ŅŃÖŖFe(OH)3µÄKsp=4”Į10£38£¬![]() ”Ö1.6 ]”£
Ӆ1.6 ]ӣ
(4)”°³ĮÄų”±µÄÄæµÄŹĒ½«ČÜŅŗÖŠµÄNi2£«×Ŗ»ÆĪŖNi(OH)2³Įµķ£¬Č·ČĻNi2£«ŅŃ¾ĶźČ«³ĮµķµÄŹµŃé·½·ØŹĒ_____________________________________”£
(5)”°ĀĖŅŗ¢ņ”±Ėłŗ¬ŅõĄė×ÓÖ÷ŅŖĪŖCl££¬Š“³ö”°Ńõ»Æ”±Ź±·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ____________________”£
(6)ŅŌFe”¢NiĪŖµē¼«ÖĘČ”Na2FeO4µÄŌĄķČēĶ¼ĖłŹ¾”£Ķصēŗó£¬ŌŚĢśµē¼«ø½½üÉś³É×ĻŗģÉ«µÄ![]() ”£µē½āŹ±Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ___________________________________£¬Ąė×Ó½»»»Ä¤(b)ĪŖ______(Ģī”°Ņõ”±»ņ”°Ńō”±)Ąė×Ó½»»»Ä¤”£
”£µē½āŹ±Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ___________________________________£¬Ąė×Ó½»»»Ä¤(b)ĪŖ______(Ģī”°Ņõ”±»ņ”°Ńō”±)Ąė×Ó½»»»Ä¤”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com