
【题目】某学生在实验室制取乙酸丁酯(已知乙酸丁酯的沸点124~126℃,反应温度115~125℃),其反应装置选择
A.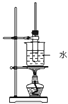 B.
B.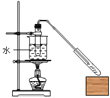 C.
C.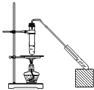 D.
D.![]()
【答案】D
【解析】
试题分析:A.该装置采用的是水浴,反应温度不超过100℃,实验室制取乙酸丁酯,反应需要反应温度为115~125℃,而水浴加热适合温度低于100℃的反应,故A错误;B.该装置采用长导管可起冷凝易挥发的乙酸和丁醇,但采用水浴,反应温度不超过100℃,实验室制取乙酸丁酯,反应需要反应温度为115~125℃,而水浴加热适合温度低于100℃的反应,故B错误;C.实验室制取乙酸丁酯,原料乙酸和丁醇易挥发,为了避免反应物损耗和充分利用原料,应设计冷凝回流装置,而该装置无冷凝装置,故C错误;D.实验室制取乙酸丁酯,原料乙酸和丁醇易挥发,当有易挥发的液体反应物时,为了避免反应物损耗和充分利用原料,要在发生装置设计冷凝回流装置,使该物质通过冷凝后由气态恢复为液态,从而回流并收集.实验室可通过在发生装置安装长玻璃管或冷凝回流管等实现,该装置符合这些要求,故D正确;故选D。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】根据下表回答问题:
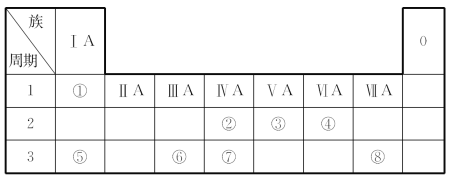
(1)元素⑦在周期表中的位置是___________________。
(2)元素①和⑤的原子序数相差 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式________________。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)________________________,
其中能与元素⑥形成的单质反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应符合绿色化学概念的是( )
A.制CuSO4:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2![]() 2CuO;CuO+H2SO4(稀)===CuSO4+H2O
2CuO;CuO+H2SO4(稀)===CuSO4+H2O
C.制Cu(NO3)2:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫能够与一些卤素单质发生反应生成强酸。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2) 中的SO2的含量。
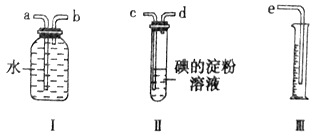
(1)若原料气以左向右流向时,上述装置组装连接的顺序是:原料气→____________(填a、b、c、d、e)。
(2)写出装置Ⅱ中发生反应的离子方程式_____________________ ;当装置Ⅱ中出现___________________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2与O2的体积为297.6 mL(己折算为标准状况下的体积),SO2的体积分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol·![]() 的氨水中逐滴加入等浓度的盐酸,溶液中
的氨水中逐滴加入等浓度的盐酸,溶液中![]() 与pH的变化关系如下图所示。下列说法不正确的是
与pH的变化关系如下图所示。下列说法不正确的是
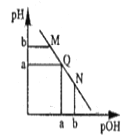
A. M点和N点溶液中![]() 的电离程度相同
的电离程度相同
B. Q点溶液中,![]()
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁元素的含量的实验(假设杂质不参加反应)。请回答下列问题:
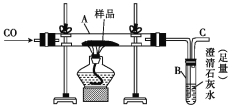
(1)该实验中炼铁的方法是 (填字母)。
A.热分解法 B.热还原法
C.电解法 D.湿法冶金
(2)实验开始后,B中的现象是 ,A中有关反应的化学方程式是 。
(3)C处须进行尾气处理,其方法是 。
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁元素的质量分数为 (结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂B.作氧化剂
C.既作氧化剂又作还原剂D.既不作氧化剂又不作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com