
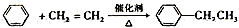

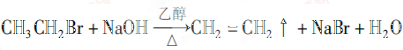 .
. 分析 ①乙烷在空气中燃烧,为燃烧反应,属于氧化反应;
②由乙炔制氯乙烯,为加成反应;
③甲烷与氯气在光照的条件下反应,为取代反应;
④乙烯使酸性高锰酸钾溶液褪色,为氧化反应;
⑤乙烯使溴的四氯化碳溶液褪色,为加成反应;
⑥实验室制乙烯,利用乙醇发生消去反应制备;
⑦由甲苯制取TNT,利用甲苯与浓硝酸发生取代反应制备;
⑧溴乙烷和氢氧化钠的乙醇溶液共热,发生消去反应生成乙烯
⑨乙苯的制备: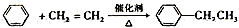 ,碳碳双键变为单键,为加成反应.
,碳碳双键变为单键,为加成反应.
解答 解:①乙烷在空气中燃烧,为燃烧反应,属于氧化反应;
②由乙炔制氯乙烯,为加成反应;
③甲烷与氯气在光照的条件下反应,为取代反应;
④乙烯使酸性高锰酸钾溶液褪色,为氧化反应;
⑤乙烯使溴的四氯化碳溶液褪色,为加成反应;
⑥实验室制乙烯,利用乙醇发生消去反应制备;
⑦由甲苯制取TNT,利用甲苯与浓硝酸发生取代反应制备;
⑧溴乙烷和氢氧化钠的乙醇溶液共热,发生消去反应生成乙烯
⑨乙苯的制备: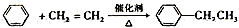 ,碳碳双键变为单键,为加成反应.
,碳碳双键变为单键,为加成反应.
(1)其中属于取代反应的是③⑦;属于氧化反应的是①④;属于加成反应的是②⑤⑨;属于消去反应的是⑥⑧,
故答案为:③⑦;①④;②⑤⑨;⑥⑧;
(2)⑦和⑧的化学方程式分别为 、
、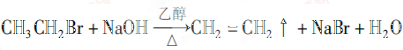 ,
,
故答案为: ;
; .
.
点评 本题考查有机物的结构与性质,为高频考点,侧重于分析与应用能力的考查,注意把握官能团与性质的关系、有机反应等为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1HA溶液的pH=4 | B. | HA溶液跟锌反应,放出H2很慢 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | 溶液中存在HA的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.6 mol/L | C. | 0.8 mol/L | D. | 1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属元素才能形成含氧酸盐 | |
| C. | 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同 | |
| D. | 非金属元素的最高价含氧酸都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com