
| A. | 溶解合金时收集到NO气体体积为2.24L(在标准状况) | |
| B. | 加入合金的质量不可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液的体积为150mL | |
| D. | 参加反应的硝酸的物质的量为0.4mol |
分析 将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,最终溶液为NaNO3溶液,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,根据电荷守恒,转移电子物质的量等于氢氧根的物质的量,
A.根据电子转移守恒计算n(NO),但NO所处的状态不确定;
B.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
C.根据守恒可知n(NaOH)=n(OH-),根据V=$\frac{n}{c}$计算加入的氢氧化钠溶液的体积;
D.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属).
解答 解:将一定量的镁和铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,最终溶液为NaNO3溶液,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,根据电荷守恒,转移电子物质的量等于氢氧根的物质的量,n(OH-)=$\frac{5.1g}{17g/mol}$=0.3mol,
A.根据电子转移守恒,n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,标准状况下0.1molNO的体积为:22.4L/mol×0.1mol=2.24L,故A正确;
B.根据电子转移守恒,镁和铜的总的物质的量为$\frac{0.3mol}{2}$=0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,加入合金的质量不可能为9.6g,故B正确;
C.根据守恒可知n(NaOH)=n(OH-)=0.3mol,加入的氢氧化钠溶液的体积=$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故C错误;
D.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属)=$\frac{8}{3}$×0.15mol=0.4mol,故D正确;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 外界条件与反应是放热还是吸热没有必然联系 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
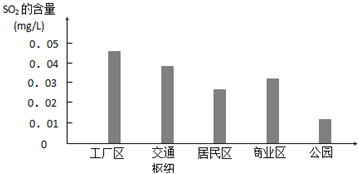
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com