
| A. | Ba(NO3)2溶液 | B. | 盐酸 | C. | 硫酸钠 | D. | 酚酞 |
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、H+ | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Na+、Al3+、Cl-、OH- | D. | K+、Ba2+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4含有4NA个电子 | |
| B. | 0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA | |
| C. | 标准状况下,11.2L H2O中分子数为0.5NA个 | |
| D. | 0.1mol•L-1 Na2CO3溶液中含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6g SiO2晶体中含有0.4NA个Si-O键 | |
| B. | PH=12的Na2CO3中有0.01NA个水分子发生了电离 | |
| C. | 标况下,11.2LHF含有的HF分子数大于0.5NA | |
| D. | 把含1molFeCl3的饱和溶液滴入沸水煮沸至红褐色透明,停止加入后,小于1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为:3X(g)+Y(g)?4Z(g);△H>0 | |
| B. | 若其它条件不变,平衡后又加入一定量X,正速率增大、逆速率减小,X的转化率减小 | |
| C. | 达到平衡后,若其他条件不变,升高温度,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,减小容器体积,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
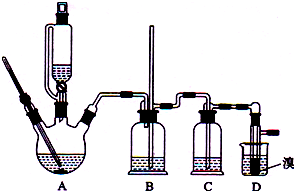
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com