
【题目】过氧化锶(SrO2)通常用作分析试剂、氧化剂、漂白剂等。制备反应原理为:Sr+O2![]() SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。

(1)选择必要仪器组装制备过氧化锶(气流按从左到右的流向):____________(填字母)。
(2)该实验制备氧气的化学方程式为______________。
(3)连接好装置并进行实验,实验步骤如下,实验操作顺序为___________(填字母)。
①打开分液漏斗活塞,将水滴入烧瓶②在相应装置中装入药品③检查装置气密性④加热
⑤停止加热⑥关闭分液漏斗活塞
(4)利用反应Sr2++H2O2+2NH3+8H2O=SrO2·8H2O↓+2NH4+,制备过氧化锶的装置如下:
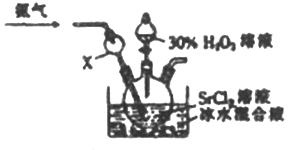
①X仪器的作用是_____________。
②氨气在该反应所起的作用是__________________。
③实验结束后,得到SrO2·8H2O的操作为_________________。
(5)设计实验证明SrO2的氧化性比FeCl3的氧化性强__________________。
【答案】ABEB2Na2O2+2H2O=4NaOH+O2↑③②①④⑤⑥防止到吸中和生成的氢离子,促进反应进行过滤、洗涤、干燥在盐酸酸化的氯化亚铁溶液中滴加硫氰化钾溶液,再向其中加少量过氧化锶,溶液变为红色,证明SrO2的氧化性比FeCl3的强
【解析】本题考查实验制备、实验方案设计的评价,(1)根据反应原理,需要制备氧气,因为锶是活泼金属与水反应,因此需要除去氧气中的水蒸气,然后通入直玻璃管中反应,同时防止空气进入E装置,因此连接顺序是ABEB;(2)制备氧气反应方程式:2Na2O2+2H2O=4NaOH+O2↑;(3)有气体参加反应,需要先检验装置的气密性,然后加入药品,打开分液漏斗活塞,排除装置的空气,对直玻璃管进行加热,发生反应,反应完全后,停止加热,关闭分液漏斗活塞,顺序是③②①④⑤⑥;(4)①NH3极易溶于水,因此作用是防止倒吸;②根据反应方程式,应是Sr2++H2O2=SrO2+2H+,通入氨气,中和H+,促进反应进行;③SrO2·8H2O是沉淀,得到SrO2·8H2O,需要过滤,洗涤,干燥;(5)在盐酸酸化的氯化亚铁溶液中滴加硫氰化钾溶液,再向其中加少量过氧化锶,溶液变为红色,证明SrO2的氧化性比FeCl3的强。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。
某小组研究在500℃下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1min | 放出热量:36.88kJ |
b | 2 | 8 | 0 | t2min | 放出热量:Q |
①容器a中,0~t1时间的平均反应速率为υ(H2)=___________。
②下列叙述正确的是________(填字母序号)。
A.容器b中反应达平衡状态时,Q>73.76kJ
B.平衡时,两容器中H2的体积分数相等
C.反应开始时,两容器中反应的化学反应速率相等
D.平衡时,容器中N2的转化率:a<b
(2)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ΔH=akJ·mol-1。
CO(NH2)2(l)+H2O(g) ΔH=akJ·mol-1。
为研究平衡时CO2的转化率与反应物投料比[![]() ]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应。(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应。(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
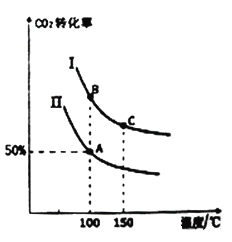
①a_______0(填“>”或“<”)。
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.4,在100℃条件下发生反应,达平衡至A点,则A点与起始压强比为_______。
③A点平衡常数与B点平衡常数间的关系:KA_______KB(填“>”或“<”或“=”)。
(3)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨—空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为_______极(填“正”或“负”),写出该电池工作时a电极的电极反应式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量SO2通入下列溶液中,最终能出现白色浑浊的是
①Ca(OH)2;②BaCl2;③NaAlO2;④Na2SiO3;⑤Ba(NO3)2;⑥苯酚钠;⑦Na2CO3
A. ①②④⑦ B. ②③⑥⑦ C. ④⑤⑥⑦ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中少量杂质的方法正确的是
A. 除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B. 除去NO2中混有的NO:用水洗气
C. 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D. 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.NaOH溶液能导电,所以NaOH溶液是电解质
B.固体KC1不导电,但KC1是电解质
C.氯水能导电,所以Cl2是电解质
D.C02的水溶液能导电,所以C02是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
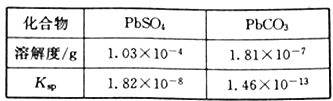
(1)步骤①转化的目的是_______,滤液1中的溶质为Na2CO3和_______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质的化学式为_______。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________。
(5)步骤⑥合成三盐的化学方程式为____________,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体,在同温同压下,两容器中的气体一定具有相同的( )
A.原子数 B.密度 C.质量 D.H的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是______(用元素符号表示)。
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为______。
(4)元素⑤与元素⑧形成的化合物的电子式为________。
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填酸的化学式)。
(6)⑤⑥两元素相比较,金属性较强的是________ (填名称),可以验证该结论的实验是_____(填字母)。
A、将在空气中放置已久的这两种元素的块状单质分别放入热水中
B、将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C、将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D、比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脍炙人口的“千锤万凿出深山,烈火焚烧若等闲;粉身碎骨浑不怕,要留清白在人间。”是明代名臣于谦的名作《石灰吟》。这四句中没有涉及化学变化的是
A.千锤万凿出深山 B.烈火焚烧若等闲
C.粉身碎骨浑不怕 D.要留清白在人间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com