
| A£® | ĻÖÓŠCO CO2 O3ČżÖÖĘųĢ壬ĖüĆĒ·Ö±š¶¼ŗ¬ÓŠ1Ħ¶ūO£¬ŌņČżÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®±Č3£ŗ2£ŗ1 | |
| B£® | 5.6gCOŗĶ22.4L CO2ÖŠŗ¬ÓŠĢ¼Ō×ÓŹżŅ»¶ØĻąµČ | |
| C£® | ±źæöĻĀ£¬11.2ÉżXĘųĢå·Ö×ÓÖŹĮæĪŖ16g£¬ŌņXĘųĢåµÄĦ¶ūÖŹĮæĪŖ32 | |
| D£® | ngCl2ÖŠÓŠmøöClŌ×Ó£¬Ōņ°¢·üŁ¤µĀĀŽ³£ŹżNAµÄŹżÖµæÉŅŌ±ķŹ¾ĪŖ 35.5m/n |
·ÖĪö A”¢CO”¢CO2”¢O3ČżÖÖĘųĢ壬ĖüĆĒŗ¬ÓŠµÄŃõŌ×ÓøöŹżÖ®±ČĪŖ1£ŗ2£ŗ3£¬ŌņŃõŌ×ÓµÄĪļÖŹµÄĮæĻąĶ¬£¬Éč¶¼ĪŖ1mol£¬Ōņn£ØCO£©=1mol£¬n£ØCO2£©=$\frac{1}{2}$mol£¬n£ØO3£©=$\frac{1}{3}$mol£¬¾Ż“Ė¼ĘĖćČżÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®±Č£»
B”¢×“æö²»ÖŖĪŽ·ØĒóĢå»ż£»
C”¢Ä¦¶ūÖŹĮæµÄµ„Ī»ŹĒg•mol-1£»
D”¢ng Cl2µÄĪļÖŹµÄĮæĪŖ$\frac{n}{71}$mol£¬Ėłŗ¬ĀČŌ×ÓŹżĪŖ£ŗ$\frac{n}{71}$”Į2NA£¬ŌņÓŠ$\frac{n}{71}$mol”Į2NA=m£¬¾Ż“Ė¼ĘĖć°¢·ü¼ÓµĀĀŽ³£Źż£®
½ā“š ½ā£ŗA”¢CO”¢CO2”¢O3ČżÖÖĘųĢ壬ĖüĆĒŗ¬ÓŠµÄŃõŌ×ÓøöŹżÖ®±ČĪŖ1£ŗ2£ŗ3£¬ŌņŃõŌ×ÓµÄĪļÖŹµÄĮæĻąĶ¬£¬Éč¶¼ĪŖ1mol£¬Ōņn£ØCO£©=1mol£¬n£ØCO2£©=$\frac{1}{2}$mol£¬n£ØO3£©=$\frac{1}{3}$mol£¬ŌņÕāČżÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ$\frac{1}{2}$£ŗ$\frac{1}{3}$=6£ŗ3£ŗ2£¬¹ŹA“ķĪó£»
B”¢ĘųĢåµÄדæö²»ÖŖĪŽ·ØĒó¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮ棬¹ŹB“ķĪó£»
C”¢Ä¦¶ūÖŹĮæµÄµ„Ī»ŹĒg•mol-1£¬ĖłŅŌMĘųĢåµÄĦ¶ūÖŹĮæŹĒ32g•mol-1£¬¹ŹC“ķĪó£»
D”¢ng Cl2µÄĪļÖŹµÄĮæĪŖ$\frac{n}{71}$mol£¬Ėłŗ¬ĀČŌ×ÓŹżĪŖ£ŗ$\frac{n}{71}$”Į2NA£¬ŌņÓŠ$\frac{n}{71}$mol”Į2NA=m£¬Ōņ°¢·ü¼ÓµĀĀŽ³£ŹżNAµÄŹżÖµæɱķŹ¾ĪŖ$\frac{35.5m}{n}$£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæµÄÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄŃ¶Č²»“ó£¬ŅŖ×¢ŅāĪļÖŹµÄĮæÓėÖŹĮ攢Ģå»ż”¢Į£×ÓŹżÄ攢ÅØ¶ČµÄ¼ĘĖć¹«Ź½µÄŌĖÓĆ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč |
| ĻņÓ²Ė®ÖŠ¼ÓČė¢Ł£ØĢīŠņŹż£©£¬Ö±µ½²»ŌŁ²śÉś³ĮµķĪŖÖ¹£® |
| ¼ĢŠųĻņČÜŅŗÖŠ¼ÓČė¢Ū£ØĢīŠņŹż£©£¬Ö±µ½²»ŌŁ²śÉś³ĮµķĪŖÖ¹£® |
| ½«ÉĻŹö»ģŗĻĪļ¹żĀĖ£ØĢī²Ł×÷£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėÉŁĮæĻõĖįŅųČÜŅŗ | B£® | ¹żĀĖ | ||
| C£® | µēÓ¾ | D£® | ÉųĪö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£®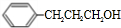
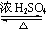
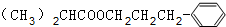 +H2O£®
+H2O£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČė3mol H2ŗĶ1molN2£¬³ä·Ö·“Ó¦ŗóæɵƵ½NH3·Ö×ÓŹżĪŖ2NA | |
| B£® | 0.1mol/L Na2SO4ČÜŅŗÖŠŗ¬ÓŠNa+ĪŖ0.2NA | |
| C£® | Ņ»¶ØĢõ¼žĻĀ£¬23 g NaÓėO2·“Ӧɜ³ÉNa2O2Ź±Ź§Č„µÄµē×ÓŹżĪŖNA | |
| D£® | ±ź×¼×“æöĻĀ£¬22.4L SO3ÖŠŗ¬ÓŠµÄĀČŌ×ÓŹżĪŖ3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
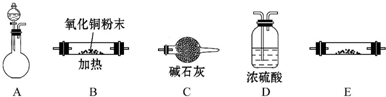
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓėNaOH·“Ó¦µÄĀČĘųŅ»¶ØĪŖ0.3 mol | |
| B£® | n£ØNa+£©£ŗn£ØCl-£© æÉÄÜĪŖ7£ŗ3 | |
| C£® | Čō·“Ó¦ÖŠ×ŖŅʵĵē×ÓĪŖn mol£¬Ōņ0.3£¼n£¼0.5 | |
| D£® | n£ØNaCl£©£ŗn£ØNaClO£©£ŗn£ØNaClO3£©æÉÄÜĪŖ11£ŗ1£ŗ2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 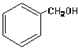 ·ÓĄą-OH ·ÓĄą-OH | B£® | 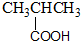 ōČĖį-CHO ōČĖį-CHO | ||
| C£® | 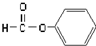 Č©Ąą-CHO Č©Ąą-CHO | D£® | CH3-O-CH3 ĆŃĄą 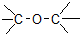 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū¢Ü | B£® | ¢Ś¢Ū¢Ü | C£® | ¢Ū¢Ü | D£® | ¢Ś¢Ü¢Ž |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com