
 CO(g)+H2(g)。
CO(g)+H2(g)。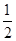 O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1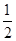 O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1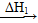 CO2(g)+H2O(g)
CO2(g)+H2O(g)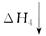

 CO(g)+H2O(g)+
CO(g)+H2O(g)+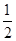 O2(g)
O2(g)科目:高中化学 来源:不详 题型:单选题
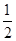 O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )| A.485.5 kJ/mol | B.610 kJ/mol |
| C.917 kJ/mol | D.1 220 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )| A.S(s)在O2(g)中燃烧的反应是放热反应 |
B.S(g)+O2(g) SO2(g) ΔH=b kJ·mol-1,则a>b SO2(g) ΔH=b kJ·mol-1,则a>b |
| C.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l)ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH2CO2NH4(s) △H1="a" kJ·mol-1
NH2CO2NH4(s) △H1="a" kJ·mol-1 CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1 CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1

 (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。| A.NH2COONH4 | B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.NaOH固体 | B.浓硫酸 | C.NH4NO3晶体 | D.Na2O2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c | B.a>c>b | C.c>b>a | D.b>a>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com