
| A. | 整个过程中共发生四个离子反应 | |
| B. | 根据现行可判断酸性强弱为:H2CO3>HAlO2>HCO3- | |
| C. | 通入3mol CO2和通入5mol CO2都只产生3mol沉淀 | |
| D. | 整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示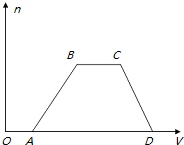 |
分析 CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序为:Ba(OH)2、NaOH、NaAlO2,则混合溶液中慢慢通入CO2,发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O、2NaOH+CO2=Na2CO3+H3O、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;若二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 、BaCO3+CO2+H2O=Ba(HCO3)2,根据反应的方程式计算.
解答 解:CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序为:Ba(OH)2、NaOH、NaAlO2,则混合溶液中慢慢通入CO2,发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O、2NaOH+CO2=Na2CO3+H3O、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 、BaCO3+CO2+H2O=Ba(HCO3)2,
A.由以上分析可知,整个过程中共发生五个离子反应,故A错误;
B.由2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3可知,酸性:H2CO3>HAlO2,反应没有生成NaHCO3,说明酸性HAlO2<HCO3-,故B错误;
C.由方程式可知,2mol NaOH、1mol Ba(OH)2、2mol NaAlO2与3mol CO2恰好反应产生3mol沉淀,再通2molCO2,只发生Na2CO3+CO2+H2O=2NaHCO3 所以沉淀的质量不变,故C正确;
D.已知发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O、2NaOH+CO2=Na2CO3+H3O、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 、BaCO3+CO2+H2O=Ba(HCO3)2,通过量的二氧化碳氢氧化铝不溶解,所以最后沉淀不为零,故D错误.
故选C.
点评 本题考查化学反应方程式的计算,把握发生的反应及反应的先后顺序为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 升高温度只能加快吸热反应的速率 | |
| B. | 对于任何反应,增大压强都可以加快反应速率 | |
| C. | 颗粒小的大理石和颗粒大的大理石跟同浓度的盐酸反应,前者反应速率快,是由于碳酸钙浓度大的缘故 | |
| D. | 催化剂能使可逆反应的正、逆反应速率同时加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.6g | B. | 10.1g | C. | 10.07g | D. | 12.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收CO,以防煤气中毒 | |
| C. | 油条制作中常加入明矾,不仅作为膨化剂,还有利于补充人体所需的微量元素 | |
| D. | 薯片、薯条等淀粉类油炸食品中丙烯酰氨(CH2=CHCONH2)含量较高,应谨慎食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
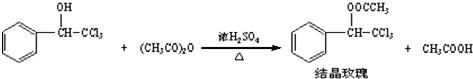
| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
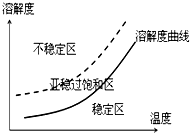
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在乙醇中,按粗产品、溶剂的质量比为1:$\frac{a}{100}$混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | 70℃时结晶玫瑰在乙醇中溶解 |
| ② | 将步骤1所得溶液冷却结晶 抽滤 | 得到白色晶体 | 在常温下结晶玫瑰在乙醇中溶解度较小 |
| ③ | 干燥步骤2所得白色晶体,加热使其融化,测其熔点 | 白色晶体在88℃左右完全熔化 | 白色晶体是结晶玫瑰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
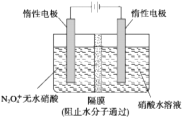 氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.
氮的氧化物的性质、用途和制备受到人们的广泛关注.请回答下列问题.| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 氢原子只有一个电子,故氢原子只有一个轨道 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com