
| A. | 浓度为0.1mol•L-1 CH3COOH溶液,加水稀释,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 浓度为0.1mol•L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大 | |
| C. | 在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S) | |
| D. | 在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动 |
分析 A、醋酸溶液加水稀释,平衡正向移动,n(CH3COO-)增大,n(CH3COOH)减小;
B、温度升高,醋酸的电离平衡正向移动,电离平衡常数增大;
C、AgCl、AgI均不溶于水,但AgI的溶解度更小;
D、催化剂能够同等程度的增大正逆反应速率,不影响平衡移动.
解答 解:A、醋酸溶液加水稀释,醋酸根离子和醋酸分子浓度都减小,平衡正向移动,n(CH3COO-)增大,n(CH3COOH)减小,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故A错误;
B、温度升高,醋酸的电离程度增大,Ka (CH3COOH)增大,故B错误;
C、在稀AgNO3溶液中先加入少量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液,发生沉淀的转化,先产生白色沉淀,后出现黄色沉淀,则说明Ksp(AgCl)>Ksp(AgI),故C正确;
D、催化剂能够同等程度的增大正逆反应速率,使用高效催化剂,正反应速率增加,逆反应速率增大,平衡不移动,故D错误;
故选C.
点评 本题考查了弱电解质加水稀释时离子浓度变化、温度对醋酸电离平衡的影响、沉淀的转化以及催化剂对反应速率和平衡的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原固体混合物中Cu与Cu2O的物质的量之比为1:1 | |
| B. | 原稀硝酸中HNO3的物质的量浓度为1.3mol•L-l | |
| C. | 产生的NO的体积为2.24L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

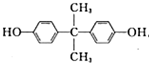 ,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.
,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯. .
. .
. .
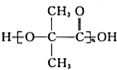
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com