
下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液CH3COONa | 比较HClO和CH3COOH的酸性强弱 |
B | 室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、FeSO4溶液,观察产生气泡的快慢。 | 比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响 |
C | 向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化。 | 比较AgCl与AgI溶解度的相对大小 |
D | 向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤。 | 除去MgCl2酸性溶液含有的少量FeCl3 |
B
【解析】
试题分析:A.NaClO和CH3COONa都是强碱弱酸盐,在溶液中弱酸根离子发生水解反应,使溶液显碱性。形成盐的酸的酸性越弱,则酸根离子的水解程度就越大,溶液的碱性就越强。故可以通过比较相同浓度的NaClO溶液CH3COONa的pH大小来比较HClO和CH3COOH的酸性强弱,正确;B.Cu2+、Fe3+都可以作H2O2分解的催化剂。室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的CuSO4、Fe2(SO4)3溶液,由于盐溶液的阴离子相同,而阳离子不同,故可以通过观察产生气泡的快慢来比较CuSO4、Fe2(SO4)3作为催化剂对H2O2分解速率的影响,但是FeSO4有还原性,可以与H2O2发生氧化还原反应,就不能作为对H2O2分解速率催化剂,错误。C.向0.1mol/LAgNO3溶液中滴加0.1mol/LNaCl溶液,至不再有白色沉淀生成,在溶液中存在AgCl的沉淀溶解平衡。当再向其中滴入0.1mol/L KI溶液,时,如果沉淀颜色由白色变为黄色,说明AgCl的溶解度大于AgI,发生了沉淀的转化,故可以比较AgCl与AgI溶解度的相对大小,正确。D.向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,由于Mg(OH)2在溶液中存在沉淀溶解平衡,由于Fe(OH)3的溶解度小于Mg(OH)2,加热并搅拌,会发生沉淀转化,杂质Fe3+形成Fe(OH)3,然后将沉淀过滤,就可以达到除杂的目的,正确。
考点:考查化学实验设计与完成预期实验目的的关系的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度为
A. B.
B. C.
C.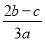 D.
D.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
关于下列各图的叙述正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列实验设计和结论相符的是
A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
D、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:

(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是 。DAB3中阴离子的立体构型是 。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有 (任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是 。
(4)AC3的沸点比氨的沸点低得多,原因是 。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:实验题
(14分)某同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究。
Ⅰ、探究硫酸的性质
(1)某同学设计下图装置(夹持和加热装置略)拟完成有关实验。但该装置在设计上存在明显的安全隐患是

(2)将上述装置改进确认不存在安全隐患并检验气密性后,将铜片放入圆底烧瓶中,通过分液漏斗向圆底烧瓶中滴加足量的浓硫酸,加热圆底烧瓶,充分反应后,观察到圆底烧瓶铜片不断溶解,但有铜片剩余,圆底烧瓶溶液呈蓝色,盛品红溶液的试剂瓶中溶液颜色褪去。回答下列问题:
①圆底烧瓶中发生反应的化学方程式为 。
②装置乙中的试剂是 。
(3)从装置中取下圆底烧瓶,向圆底烧瓶的溶液中持续鼓入空气并加热圆底烧瓶。观察到圆底烧瓶中的红色固体逐渐溶解并完全消失。此时发生反应的离子方程式为
(4)若要用(3)问所得溶液来制备硫酸四氨合铜晶体,其操作是 。
Ⅱ、用KHSO4制取H2O2并测其物质的量浓度。
(1)工业上电解KHSO4饱和溶液制取H2O2的示意图如下(已知:KHSO4=K++H++SO42-):

电解饱和KHSO4溶液时反应的离子方程式 。
(2)测定H2O2的物质的量浓度:
取20.00mL上述已制得的H2O2溶液置于锥形瓶中,加稀硫酸酸化 ②用0.1000mol/LKMnO4溶液滴定 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL,原H2O2溶液中H2O2的物质的量浓度为 。
(已知:滴定时该反应的还原产物是Mn2+,氧化产物是O2)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.Cl2O和NO2均是酸性氧化物 B.水玻璃和氨水均是混合物
C.烧碱和三氧化硫均为电解质 D.牛奶和氯化铝溶液均为胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
除去被提纯物质中的杂质,方案正确的是
编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
下列物质可用作食品添加剂的是
A.CH3OH B.CH3 CH2OH C.HCHO D.I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com