
分析 (1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中$\frac{{c(S{O_4}^{2-})}}{{c(C{O_3}^{2-})}}$的分子分母同乘以钡离子的浓度,即$\frac{Ksp[BaS{O}_{4}]}{Ksp[BaC{O}_{3}]}$;
(2)已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)据此计算.
解答 解:(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中$\frac{{c(S{O_4}^{2-})}}{{c(C{O_3}^{2-})}}$的分子分母同乘以钡离子的浓度,即$\frac{Ksp[BaS{O}_{4}]}{Ksp[BaC{O}_{3}]}$=$\frac{1.1×1{0}^{-30}}{5.1×1{0}^{-9}}$=2.16×10-22,故答案为:2.16×10-22;
(2)已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=(-221)×2-(+460)-(+571.2)=-1473.2KJ•mol-1,
故答案为:-1473.2KJ•mol-1.
点评 本题考查了热化学方程式及盖斯定律的应用,明确盖斯定律的含义和构建目标方程式的方法是解题的关键,题目难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:解答题
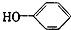 合成
合成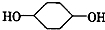 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)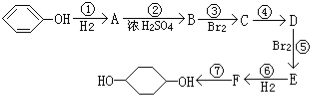
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.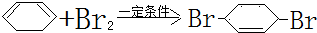 ,写出在同样反应条件下
,写出在同样反应条件下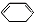 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)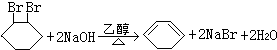 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
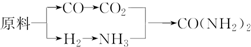
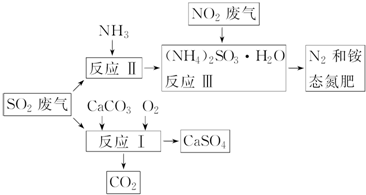
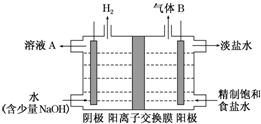
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
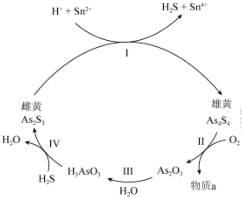
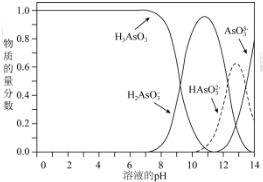
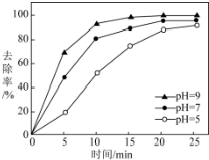
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA | |
| D. | 3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com