
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:
(1)若要比较镁、铝的金属性强弱,下列方案可行的是:____________(填序号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将等量的这两种元素的单质粉末分别与同浓度的盐酸反应
c.将这两种元素的单质粉末分别与热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:______________________________________________。
(3)利用如图装置(夹持装置省略)可以验证部分元素的非金属性强弱。
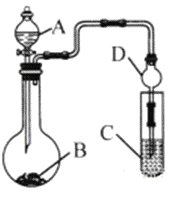
①实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的化学方程式为:_____________________________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为:_____________________________。
②若要自选药品证明非金属性:C>Si,则A中加__________、B中加Na2CO3粉末、C中加_____________,观察到C中溶液的现象为_________________________。
【答案】bc 不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较, NH3·H2O不是N元素最高价氧化物对应的水化物 2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O S2-+Cl2 =S↓+2Cl- 硫酸 Na2SiO3溶液 有白色胶状沉淀产生
【解析】
(1)比较镁、铝的金属性强弱,可以根据它们的单质与水或酸反应的快慢、最高价氧化物对应的水化物的碱性强弱判断;
(2)元素的最高价氧化物的水合物碱性越强,其金属性越强;
(3)①要证明非金属性Cl>S,只要证明其单质的氧化性:Cl2>S即可,A中盛放液体、B中盛放固体、C中盛放液体,氯气用浓盐酸和高锰酸钾制取,氯气和硫化钠反应生成S和NaCl;装置C中有淡黄色固体生成,该固体是S;
②C中是硅酸钠溶液,如要证明非金属性:C>Si,应该比较其最高价氧化物的水合物酸性强弱,则A和B中物质反应生成二氧化碳,然后二氧化碳和硅酸钠反应生成硅酸即可证明。
(1) a.将在空气中放置已久的这两种元素的块状单质分别放入热水中,金属与空气中的氧气反应产生氧化物对金属起到保护作用,不能进行比较判断,a错误;
b.将等量的这两种元素的单质粉末分别与同浓度的盐酸反应,金属越活泼,置换出酸中的氢就越容易,反应越剧烈,可以比较判断,b正确;
c.将这两种元素的单质粉末分别与热水作用,并滴入酚酞溶液金属越活泼,反应产生的金属氢氧化物的碱性就越强,滴入酚酞,溶液的红色就会越深,可以比较判断,c正确;
d.比较这两种元素的氢化物都是离子化合物,不是气体,d不能判断比较,d错误;
故合理选项是bc;
(2)元素的最高价氧化物的水合物碱性越强,其金属性越强,一水合氨不是N元素的最高价氧化物的水合物,所以不能比较二者的金属性强弱;
(3)①要证明非金属性Cl>S,只要证明其单质的氧化性:Cl2>S即可,A中盛放液体物质浓盐酸、B中盛放固体KMnO4、C中盛放液体硫化钠溶液,氯气用浓盐酸和高锰酸钾制取,烧瓶中发生反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+2KCl+8H2O;C中盛放硫化钠溶液,氯气和硫化钠反应生成S和NaCl;装置C中有淡黄色固体生成,该固体是S,反应的离子方程式为S2-+Cl2=S↓+2Cl-;
②C中是硅酸钠溶液,如要证明非金属性:C>Si,应该比较其最高价氧化物的水合物酸性强弱,则A和B中物质反应生成二氧化碳,然后二氧化碳和硅酸钠反应生成硅酸即可证明,所以A中盛放稀硫酸、B中盛放Na2CO3溶液,稀硫酸与Na2CO3 溶液反应产生的CO2气体通入Na2SiO3溶液中,发生反应:CO2+H2O+ Na2SiO3=Na2CO3+H2SiO3↓,观察到C中溶液的现象为有白色胶状沉淀产生。


科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式_________________________________。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是________________________,B在反应中表现出的性质是_______、______。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式________;实验室检验C的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 有机化合物中每个碳原子最多形成4个共价键
B. 乙烯能使酸性高锰酸钾溶液和溴水褪色,但二者反应原理不相同
C. 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
D. 乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com