
【题目】设阿伏加德罗常数的数值为NA,则下列说法正确的是( )
A. 常温常压下,11.2 L甲烷中含有的氢原子数为2NA
B. 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3×6.02×1023
C. 标准状况下,2.7 g Al与足量的盐酸反应,生成H2的体积是22.4L
D. 常温下,1 L 0.1 mol·L-1MgCl2溶液中含Cl-数为0.2moL
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
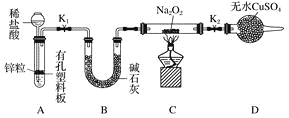
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______、_________。(填标号)
A. B.
B.
C. D.
D.![]()
(2)![]() 与
与![]() 具有相同的电子构型,
具有相同的电子构型,![]() 小于
小于![]() ,原因是___________________________。
,原因是___________________________。
(3)![]() 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,![]() 中的阴离子空间构型是____________________。
中的阴离子空间构型是____________________。

(4)如图,Li原子的第一电离能为_________![]() ,O=O键键能为_________
,O=O键键能为_________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
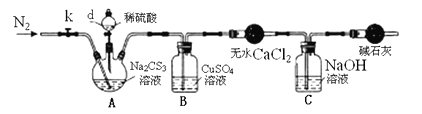
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
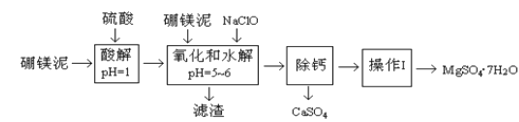
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加适量的水溶解。将配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:__________(填选项)
A.①②③ B.②⑥⑤ C.④⑥① D.①④⑥ E.⑥①④ F.⑥②⑤
(2)将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:_______________________________________________________
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量____g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、_________
和_______________
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L是偏小的是__________
A.在上述(2)步中没有使用盐酸处理滤液;
B.在上述(3)步中没有对烧杯和玻璃棒进行洗涤;
C.定容时俯视凹液面;
D.上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=H++Cl-+HClO
B.Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.将浓盐酸与MnO2混合加热:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
D.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用规范的化学用语回答下列问题
(1)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置__________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________,为检测Cl-杂质是否除干净,应进行的操作_________________________________
②从碘水中分离出I2的方法,名称为________________________。
③装置A中①的名称是________,进水的方向是从______(填“上”“下”)口进水,装置B在分液时为使液体顺利下滴,应进行的具体操作是_______________________。
(2)实验室配制Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,并继续加热至溶液呈红褐色,停止加热。向所得胶体中逐滴加入稀硫酸,开始观察到的现象是__________,这种现象称为胶体的________;最后观察到的现象是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com