
| 1mol��4 |
| 1 |
| 1mol��1 |
| 1 |
| ||
| ||
|


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
34 16 |
| A���˵����Ϊ34 |
| B��������Ϊ16 |
| C�����������Ϊ18 |
| D��ԭ������Ϊ16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ѹ��������ʡ�ļ������������� |
| B����ǿ����������ˮ�ѵ����״���������ˮ�帻Ӫ���� |
| C�������ƹ�̫���ܡ����ܡ������ܼ�ˮ�ܵȵ�ʹ�ã����ٻ�ʯȼ�ϵ�ʹ�� |
| D������ʵʩ����ȼ�ϡ������������������������������͵�����������Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��F��G�ǵ��ʣ�����A��F�ǽ������ʣ�F���л�ɫ����ɫ��Ӧ��G�ǻ���ɫ���壻B��C��D��E�ǻ����E��D������Ϊ��ɫ������Ϊ����ɫ������Ϊ���ɫ������֮�������ͼ��ʾ��ת����ϵ��������û��ȫ��д������
A��F��G�ǵ��ʣ�����A��F�ǽ������ʣ�F���л�ɫ����ɫ��Ӧ��G�ǻ���ɫ���壻B��C��D��E�ǻ����E��D������Ϊ��ɫ������Ϊ����ɫ������Ϊ���ɫ������֮�������ͼ��ʾ��ת����ϵ��������û��ȫ��д�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 25 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
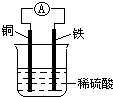 ��ͼΪͭ��ԭ���ʾ��ͼ�������й�˵����ȷ���ǣ�������
��ͼΪͭ��ԭ���ʾ��ͼ�������й�˵����ȷ���ǣ�������| A��ͭ�����ܽ� |
| B����װ���ܽ�����ת��Ϊ��ѧ�� |
| C������������ͨ����������ͭ�� |
| D��������ӦΪFe-2e-=Fe2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com