
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ? | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
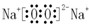 ;钠元素的焰色反应呈黄色;过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为 2Na2O2+2H2O═4Na++4OH-+O2↑,
;钠元素的焰色反应呈黄色;过氧化钠和水反应生成氢氧化钠和氧气,离子方程式为 2Na2O2+2H2O═4Na++4OH-+O2↑,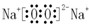 ;黄色;2Na2O2+2H2O═4Na++4OH-+O2↑;
;黄色;2Na2O2+2H2O═4Na++4OH-+O2↑; ,故答案为:离子键;
,故答案为:离子键;  .
.


科目:高中化学 来源: 题型:
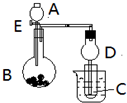 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
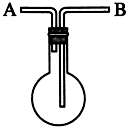 利用如图装置收集以下7种气体:(填气体序号或A或B)
利用如图装置收集以下7种气体:(填气体序号或A或B)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| B、试剂瓶玻璃塞被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O |
| C、常温下,氯气通入氢氧化钠溶液中:Cl2+2OH-═ClO-+Cl- |
| D、误将洁厕灵与84消毒液混合:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com