
已知:
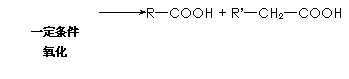 |
![]() R—CH2—C—CH2—R’
R—CH2—C—CH2—R’
|
|
|
|
已知:A的结构简式为:CH3—CH(OH)—CH2—COOH ,现将A进行如下反应,B不能发生银镜反应, D是食醋的主要成分, F中含有甲基,并且可以使溴水褪色。
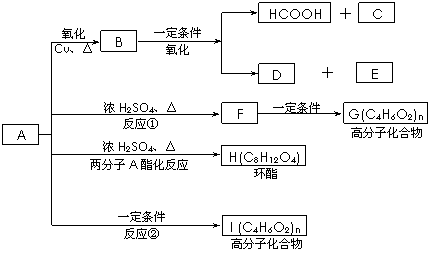 |
(1)写出C、E的结构简式:C_________ _、E_______ ;
(2)反应①和②的反应类型:①____________反应、②____________ 反应;
(3)写出下列化学方程式:
② F→G:_________________________________________________ ;
③ A→H:_________________________________________________ ;
科目:高中化学 来源: 题型:阅读理解
 通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:
通过实验测定反应速率的方法有多种,为证明化学反应速率与反应的浓度有关.有同学设计如下实验:| 序号 | Na2S2O3溶液 | 稀H2SO4 | 出现混浊时间 | ||
| 浓度 | 用量 | 浓度 | 用量 | ||
| (1) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 10mL | t1 |
| (2) | 0.1mol?L-1 | 10mL+5mL 水 | 0.1mol?L-1 | 10mL | t2 |
| (3) | 0.1mol?L-1 | 10mL | 0.1mol?L-1 | 5mL+5mL水 | t3 |
| (4) | 0.1mol?L-1 | 5mL | 0.1mol?L-1 | 5mL | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com