
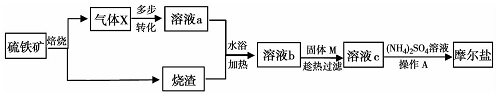
分析 由流程图可知:硫铁矿焙烧:4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2↑,则烧渣主要成分为Fe2O3,气体X为二氧化硫,X经多步转化为硫酸溶液,再与烧渣得到溶液b为硫酸铁溶液,加入固体M得溶液c,c与硫酸铵得到摩尔盐,则c为亚铁离子的溶液,故固体M应为铁粉,溶液c为硫酸亚铁溶液,向其中加入硫酸铵经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥制得的硫酸亚铁铵晶体,据此分析.
解答 解:硫铁矿焙烧:4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2↑,则烧渣主要成分为Fe2O3,气体X为二氧化硫,X经多步转化为硫酸溶液,再与烧渣得到溶液b为硫酸铁溶液,加入固体M得溶液c,c与硫酸铵得到摩尔盐,则c为亚铁离子的溶液,故固体M应为铁粉,溶液c为硫酸亚铁溶液,
(1)提高硫铁矿反应速率的措施有粉碎硫铁矿增大接触面积,搅拌加速反应等;
故答案为:粉碎、搅拌等;
(2)气体X为二氧化硫,则400℃时,催化剂作用下气体X与空气反应的化学方程式为:2SO2+O2$\frac{\underline{\;\;\;400℃\;\;\;}}{催化剂}$2SO3;
故答案为:2SO2+O2$\frac{\underline{\;\;\;400℃\;\;\;}}{催化剂}$2SO3;
(3)溶液b为硫酸铁溶液,加入固体M得溶液c,c与硫酸铵得到摩尔盐,则c为亚铁离子的溶液,故固体M应为铁粉,趁热过滤的目的是避免温度降低,硫酸亚铁晶体析出而造成损失;
故答案为:铁粉;趁热过滤的目的是避免温度降低,硫酸亚铁晶体析出而造成损失;
(4)向硫酸亚铁溶液中加入硫酸铵经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥制得的硫酸亚铁铵晶体;摩尔盐不溶于乙醇,故为了减少产品的溶解,且便于产品干燥,选择乙醇洗涤晶体;
故答案为:冷却结晶;减少产品的溶解,且便于产品干燥;
(5)①滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
故答案为:滴入高锰酸钾溶液不褪色且半分钟不变;
②高锰酸钾与Fe2+的反应是MnO4-~Mn2+~5e-;Fe2+~Fe3+~e-;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
③根据5Fe2+~MnO4-,则n(摩尔盐)=n(Fe2+)=5n(MnO4-)=5×0.1000mol/L×0.01L=0.005mol,产品中摩尔盐的质量为:0.005mol×392g/mol=1.96g,则该产品的纯度为:$\frac{1.96g}{2g}×100%$=98%;
故答案为:98%.
点评 本题以莫尔盐的制备为载体,考查物质分离提纯、氧化还原反应滴定应用以计算、以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O | |
| D. | 主链上有5个碳原子的庚烷有5 种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做电解池的阴极,和外加电源的负极相连 | |
| B. | 做电解池的阴极,和外加电源的正极相连 | |
| C. | 做电解池的阳极,和外加电源的负极相连 | |
| D. | 做电解池的阳极,和外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应③为放热反应 | |
| B. | 当容器内湿埋不再变化时,上述各反应均达到化学平衡状态 | |
| C. | 当混合气体的密度不再变化时,上述各反应均达到化学平衡状态 | |
| D. | 若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=2K1•K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发过程中用玻璃棒不断搅拌 | |
| B. | 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中 | |
| C. | 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干 | |
| D. | 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com