
����Ŀ��������������һ������Ư�ס����������㷺Ӧ����ũҵ��ҽҩ�����û����������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ��������أ���Ӧ�ķ���ʽΪ��CO��NH2��2+H2O2 ![]() CO��NH2��2H2O2 �� ���������صIJ����������£�
CO��NH2��2H2O2 �� ���������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO��NH2��2H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̣���ͼ1������Ӧװ��ͼ2��
��ش��������⣺
��1������X��������������������ȴˮ�����a����b�����ڽ��룻
��2����Ӧ���ļ��ȷ�ʽ�� ��
��3���������Ƿ�������ʲ�������ǡ�����ԭ������
��4������ٲ��ü�ѹ������ԭ���� ��
��5��ĸҺ����ѭ��ʹ�����ԭ�������ʣ�������ĸҺ�з����H2O2�����أ��ɲ��õIJ����� ��
A.����������
B.��ѹ���ᾧ
C.��Һ������
D.��ѹ������ȡ
��6��ȷ��ȡ0.5000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�1mL 6molL��1 H2SO4 �� ��0.1000molL��1 KMnO4����Һ�ζ����յ�ʱ����20.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO��NH2��2H2O2����������Ϊ�����ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ�����õĹ��������غ������ƫ�ߡ�����ƫ�͡����䡱����
���𰸡�
��1��������ƿ��a
��2��ˮԡ����
��3������Ϊ����˫��ˮ��Ӧ���������ӣ����������ִٽ�˫��ˮ�ֽ�
��4���������������¶ȸ���45��ʱ�ᷢ���ֽ�
��5��B
��6��94%��ƫ��
���������⣺��1������װ��ͼ��֪����XΪ������ƿ������ˮӦ�ô��¿����룬��������Ч���ã�������ˮ��a�����룻���Դ��ǣ�������ƿ��a����2��CO��NH2��2H2O2���Ʊ��¶Ƚϵͣ�CO��NH2��2H2O2��45��ʱ�����ֽ⣬���Բ����þƾ���ֱ�Ӽ��ȣ�Ӧ����ˮԡ���ȣ�
���Դ��ǣ�ˮԡ���ȣ���3������������Fe��Ӧ�������������ӣ����������ӻ���ٹ�������ķֽ⣬���Խ��������������ʲ��ϵģ�
���Դ��ǣ�����Ϊ����˫��ˮ��Ӧ���������ӣ����������ִٽ�˫��ˮ�ֽ⣻��4���������������¶ȸ���45��ʱ�ᷢ���ֽ⣬���ü�ѹ����ʱ��Һ���ڽϵ��¶��¼��ɻӷ������Է�ֹ���������ط����ֽ⣻
���Դ��ǣ��������������¶ȸ���45��ʱ�ᷢ���ֽ⣻��5��ĸҺ����ѭ��ʹ�����ԭ�������ʣ�ĸҺ�к���H2O2�����أ���ѹ�������õ�H2O2 �� Ȼ��ᾧ�õ����أ�
���Դ��ǣ�B����6����֪������KMnO4��Һ����Ӧ�������ķ�ӦΪ5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2����
5H2O2����������2KMnO4
5 2
nmol 0.1000molL��1��0.02L
��n=0.005mol������CO��NH2��2H2O2Ϊ0.005mol��������Ϊ0.005mol��94g/mol=0.47g
���Բ�Ʒ��CO��NH2��2H2O2����������Ϊ ![]() ��100%=94%��
��100%=94%��
���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ����ζ�ʱ���ĵĸ���������ƫ������ص����ʵ���ƫ�����������CO��NH2��2H2O2������ƫ��õĹ��������غ���ƫ�ߣ�
���Դ��ǣ�94%��ƫ�ߣ�


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���������Fe�ۺ�Cu�۵Ļ�����Ʊ�CuSO45H2O��FeSO4��NH4��2SO46H2O�Ĺ���������ͼ1��ʾ��
��֪���ټ������ʵ��ܽ�ȣ�g/100gH2O�������ʾ��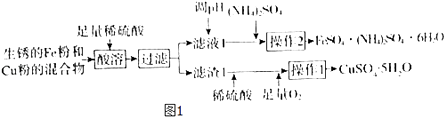
FeSO47H2O | ��NH4��2SO4 | FeSO4��NH4��2SO46H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
����ҺpH��4ʱ��Fe2+���ױ�������
��ش�
��1���������õ���Ҫ��������Ϊ ��
��2����Һ1�е���Ҫ����Ϊ���ѧʽ����
��3�����в���2ʱ������Һ���������������ȹ��ˣ�ԭ��Ϊ ��
��4��FeSO4��NH4��2SO46H2O������ϡ����ϴ�ӣ���������ˮϴ�ӵ�ԭ��Ϊ ��
��5����ȡ2.50gCuSO45H2O��Ʒ�����չ�������Ʒ�������¶ȣ�T���仯��������ͼ2��ʾ�� 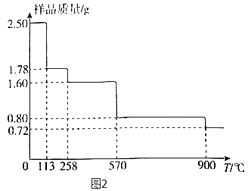
��120�����Ĺ��壬����������258��ʱʧˮ����������Ӧ�Ļ�ѧ����ʽΪ ��
��900��ʱʣ�����ֻ��һ��ͭ��������仯ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��g��+B��g��C��g��+D��g����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
|�¶�/�� | 700 | 800 | 900 | 1000 | 1200 |
ƽ�ⳣ�� | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H=0���������������=������
��2��900��ʱ����һ���̶�����Ϊ2L���ܱ������г���0.20mol��A��0.80mol��B������Ӧ��ʼ��2s��AŨ�ȱ仯0.05molL��1 �� ��A��ƽ����Ӧ����v��A��= �� �÷�Ӧ�ﵽƽ��ʱA��ת����Ϊ �� �����ʱ����ܱ��������ٳ���1mol�����ƽ��ʱA��ת����Ϊ������ ����С�����䡱��
��3���жϷ�Ӧ�Ƿ�ﵽƽ�������Ϊ������ĸ���ţ���
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c��A������ʱ�ʸı� d����λʱ��������C��D�����ʵ������
��4��1200��ʱ��������һ��ͬ�����г���0.30molA��0.40mol B��0.40mol C��0.50mol D����ʱv��v��������ڡ�����С�ڡ����ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пһ����ȼ�ϵ�ؿ����綯��������Դ���������ҺΪKOH����ӦΪ2Zn+O2+2H2O+4OH��=2Zn��OH��42�� �� ����˵����ȷ���ǣ� ��
A.�ŵ�ʱ���������Һ��K+����
B.�ŵ�ʱ���������Һ��pH ����
C.���ʱ�������ķ�ӦΪ��Zn��OH��42��+2e��=Zn+4OH��
D.���ʱ������4.48L ��������״���£��ͷų���ʱ������������ZnΪ13g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�ı���������
A. ��������ֱ����1-100nm֮�� B. �������Ӵ����
C. ���������ܴ�����ֽ D. ������ж����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijֲ��Ӫ��Һ�ɲ��䵪���ס���Ԫ�أ���ɷּ����������ʾ��
�ɷ� | ���� |
����� | 260 |
����� | 250 |
�������� | 345 |
����þ | 537 |
����� | 237 |
��1�������Ԫ�ص������� �� ����뷽��ʽΪ ��
��2����Ӫ��Һ���ڼ�������ʹ�ã���ʹ���ʷ�Ч���ͣ���ԭ���� ��
��3����Ӫ��Һ����Ԫ�ص�Ũ��Ϊmol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���Ȼ�������Ҫ�Ļ���ԭ�ϣ��㷺�������л��ϳɴ�����
ʵ�������Դ�ͭ��������Fe��Ϊԭ�ϣ�ij���Ʊ�ͭ���Ȼ����������ͼ1��
��Ҫ��ش��������⣺
��1���ڽ��в�����֮ǰ��Ҫȷ����Һ�������Ѿ���ȫ����������ľ�������������� ��
��2�����������У����ù���1��Ҫ��ϡ�����ܽ⣬����������
��3����Һ1�ɼ��Լ�X���ڵ���pH�Գ�ȥ���ʣ�X��ѡ�������Լ��еģ�����ţ� ��
a��NaHCO3 b��NH3H2O c��CuO d��Cu2��OH��2CO3
��4��������ͼ2��ʾ��ʵ��������ҩƷ���Ʊ���������������������ͭ��Ӧ������̨������ʡ�ԣ���
�ٰ������������Ӹ������ӿ�˳���ǣ�a����������f��g�� ��
��Ϊ�˷�ֹ��������ͭ��ʵ��ʱ�ڴ��Թܼ���ǰҪ����һ����Ҫ������������� ��
��ʵ������У�����ʳ��ˮ�г����������ǵ��������û�ѧ���ԭ����֪ʶ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������й�Cu�����ᡢ���ữѧ���ʵ�ʵ�飬ʵ�������ͼ��ʾ�������й�˵����ȷ����
�� ��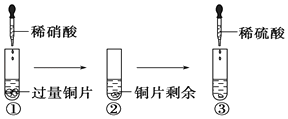
A.������Һ����ɫ���Թܿ��к���ɫ���������ϡ���ᱻ��ԭΪNO2
B.���з�Ӧ�Ļ�ѧ����ʽ��3Cu+Cu��NO3��2+4H2SO4=4CuSO4+2NO��+4H2O
C.���еμ�ϡ���ᣬͭƬ�����ܽ⣬˵��ϡ����������Ա�ϡ����ǿ
D.������ʵ���֪��Cu�ڳ����¼ȿ���ϡ���ᷴӦ��Ҳ����ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com