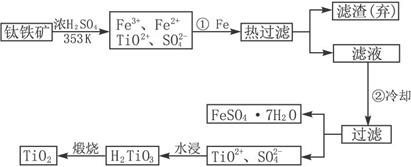
īŃ£ØTi£©±»³ĘĪŖ¼ĢĢś”¢ĀĮÖ®ŗóµÄµŚČż½šŹō£¬īŃ°×£ØTiO
2£©ŹĒÄæĒ°×īŗƵİ×É«ŃÕĮĻ£®ÖʱøTiO
2ŗĶTiµÄŌĮĻŹĒīŃĢśæó£¬ĪŅ¹śµÄīŃĢśæó“¢Įæ¾ÓŹĄ½ēŹ×Ī»£®ŗ¬ÓŠFe
2O
3µÄīŃĢśæó£ØFeTiO
3£©ÖĘČ”TiO
2µÄĮ÷³ĢČēĻĀ£ŗ
£Ø1£©TiµÄŌ×ÓŠņŹżĪŖ22£¬TiĪ»ÓŚŌŖĖŲÖÜĘŚ±ķÖŠµŚ
ĖÄ
ĖÄ
ÖÜĘŚ£¬µŚ
¢ōB
¢ōB
×壮
£Ø2£©²½Öč¢Ł¼ÓFeµÄÄæµÄŹĒ
½«Fe3+»¹ŌĪŖFe2+
½«Fe3+»¹ŌĪŖFe2+
£»²½Öč¢ŚĄäČ“µÄÄæµÄŹĒ
Īö³ö£Ø»ņ·ÖĄė”¢»ņµĆµ½£©FeSO4?7H2O
Īö³ö£Ø»ņ·ÖĄė”¢»ņµĆµ½£©FeSO4?7H2O
£®
£Ø3£©ÉĻŹöÖʱøTiO
2µÄ¹ż³ĢÖŠ£¬æÉŅŌĄūÓƵÄø±²śĪļŹĒ
FeSO4?7H2O
FeSO4?7H2O
£»æ¼ĀĒ³É±¾ŗĶ·ĻĪļ×ŪŗĻĄūÓĆŅņĖŲ£¬·ĻŅŗÖŠÓ¦¼ÓČė
ŹÆ»Ņ£Ø»ņĢ¼ĖįøĘ”¢·Ļ¼ī£©
ŹÆ»Ņ£Ø»ņĢ¼ĖįøĘ”¢·Ļ¼ī£©
“¦Ąķ£®
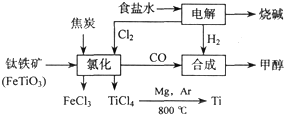
£Ø4£©ÓɽšŗģŹÆ£ØTiO
2£©ÖĘČ”µ„ÖŹTi£¬Éę¼°µ½µÄ²½ÖčĪŖ£ŗŅŃÖŖ£ŗ
¢ŁC£Øs£©+O
2£Øg£©=CO
2£Øg£©£»”÷H=-393.5kJ?mol
-1
¢Ś2CO£Øg£©+O
2£Øg£©=2CO
2£Øg£©£»”÷H=-566kJ?mol
-1
¢ŪTiO
2£Øs£©+2Cl
2£Øg£©=TiCl
4£Øs£©+O
2£Øg£©£»”÷H=+141kJ?mol
-1ŌņTiO
2£Øs£©+2Cl
2£Øg£©+2C£Øs£©=TiCl
4£Øs£©+2CO£Øg£©µÄ”÷H=
-80kJ?mol-1
-80kJ?mol-1
£®·“Ó¦TiCl
4+2Mg=2MgCl+Ti ŌŚArĘų·ÕÖŠ½ųŠŠµÄĄķÓÉŹĒ
·ĄÖ¹øßĪĀĻĀMg£ØTi£©ÓėæÕĘųÖŠµÄO2£Ø»ņCO2”¢N2£©×÷ÓĆ
·ĄÖ¹øßĪĀĻĀMg£ØTi£©ÓėæÕĘųÖŠµÄO2£Ø»ņCO2”¢N2£©×÷ÓĆ
£®





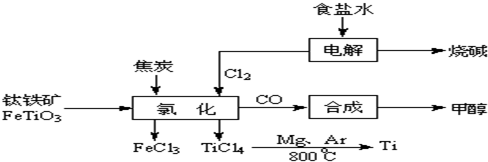
 2OH-+H2ӟ+Cl2ӟ
2OH-+H2ӟ+Cl2ӟ 2OH-+H2ӟ+Cl2ӟ
2OH-+H2”ü+Cl2”ü 2MgCl2£Øs£©+Ti£¬ŌŚArĘų·ÕÖŠ½ųŠŠµÄĄķÓÉŹĒ£ŗ
2MgCl2£Øs£©+Ti£¬ŌŚArĘų·ÕÖŠ½ųŠŠµÄĄķÓÉŹĒ£ŗ
