
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.分析 (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气.
解答 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,a电极反应式为Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;
(2)阳极上铁失电子发生氧化反应生成亚铁离子,阴极上氢离子放电生成氢气,同时溶液中生成氢氧根离子,氢氧根离子和亚铁离子反应生成氢氧化亚铁,所以电解质溶液为酸或含有不如氢离子氧化性强的金属化合物作电解质的溶液,
A.水的导电性差,故不选;
B.电解氯化钠溶液时,阴极上氢离子放电,符合条件,故选;
C.电解氢氧化钠溶液时,阴极上氢离子放电,符合条件,故选;
D.电解氯化铜溶液时,阴极上铜离子放电,不符合条件,故不选;
故选B、C;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对c溶液进行加热煮沸的目的是排出溶液中的氧气,故答案为:隔绝空气防止氢氧化亚铁被氧化.
点评 本题考查了电解原理,根据实验目的确定阴极材料及电解质溶液,明确离子放电顺序是解本题关键,难点是电解质溶液的确定,题目难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从下口放出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线 | |
| C. | 用淘洗的方法从沙里淘金 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
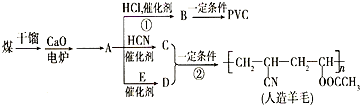 近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好.如图是以煤为原料生产(PVC)和人造羊毛的合成路线.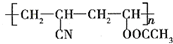 .
.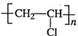 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
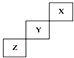
| A. | X单质的熔点比Z的低 | |
| B. | X、Y、Z三种元素中,X的非金属性最强 | |
| C. | Y氢化物的稳定性比Z的氢化物弱 | |
| D. | Y的最高正化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com